
【题目】下列反应一定属于吸热反应的是 ( )
A. 酸碱中和反应
B. 需要加热的反应
C. 化学键断裂吸收的能量比化学键形成放出的能量少的反应
D. 氢氧化钡晶体和氯化铵晶体的反应
科目:高中化学 来源: 题型:
【题目】利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:

(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为 ;“水解”采用90℃而不在室温下进行的原因是 。
(2)“酸溶”时,Al2O3发生反应的离子方程式为 。
(3)“氧化”时,发生反应的离子方程式为________________________________。
(4)“废渣”成分为______________(填化学式)。
(5)采用喷雾干燥而不用蒸发的原因是______________________。
(6)煅烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3 + 2NH3↑
2Al2O3 + 2NH3↑ + N2↑ + 5SO3↑ + 3SO2↑ + 53H2O,将产生的气体通过如右图所示的装置。则集气瓶中收集到的气体是 (填化学式)。
+ N2↑ + 5SO3↑ + 3SO2↑ + 53H2O,将产生的气体通过如右图所示的装置。则集气瓶中收集到的气体是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+2H2(g)![]() CH3OH(g) ΔH=Q kJ·mol-1;在三个不同容积的容器中分别充入1 mol CO与2 mol H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是
CH3OH(g) ΔH=Q kJ·mol-1;在三个不同容积的容器中分别充入1 mol CO与2 mol H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是
温度(℃) | 容器体积 | CO转化率 | 平衡压强(p) | |
① | 200 | V1 | 50% | p1 |
② | 200 | V2 | 70% | p2 |
③ | 350 | V3 | 50% | p2 |
A.反应速率:③>①>②
B.平衡时体系压强:p1∶p2=5∶4
C.若容器体积V1>V3,则Q<0
D.若实验②中CO和H2用量均加倍,则CO转化率<70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为___________反应(填“吸热”或“放热”),且m+n____________p(填“>”“=”“<”)。
(2)减压使容器体积增大时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(维持体积不变),则A的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比![]() 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,则加入C(容器体积不变)时混合物颜色______ _;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应aA(g)+bB(g)![]() cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )

A.T1<T2,P1<P2,a+b>c,Q<0
B.T1>T2,P1<P2,a+b<c,Q>0
C.T1<T2,P1>P2,a+b<c,Q>0
D.T1<T2,P1>P2,a+b>c,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1.01×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ·mol-1
B.H2O(g)=H2(g)+![]() O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
C.H2(g)+![]() O2(g)=H2O(g) ΔH=-484kJ·mol-1
O2(g)=H2O(g) ΔH=-484kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1) Zn2+在基态时核外电子排布式为 。
(2) SO42-的空间构型是 (用文字描述)。
(3) PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3, CH2=CH-CHO, HCOOH, CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是 。
a.N2O结构式可表示为N=N=O
b.O3分子呈直线形
c.CH2=CH-CHO分子中碳原子均采用sp2杂化
d.相同压强下HCOOH沸点比CH3OCH3高,说明前者是极性分子后者是非极性分子
②1mo1PAN中含σ键数目为 。
③NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]S04,该配合物中心离子的配位数为 (填数字).
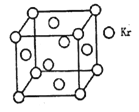
(4)测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n= (填数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com