
【题目】利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:

(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为 ;“水解”采用90℃而不在室温下进行的原因是 。
(2)“酸溶”时,Al2O3发生反应的离子方程式为 。
(3)“氧化”时,发生反应的离子方程式为________________________________。
(4)“废渣”成分为______________(填化学式)。
(5)采用喷雾干燥而不用蒸发的原因是______________________。
(6)煅烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3 + 2NH3↑
2Al2O3 + 2NH3↑ + N2↑ + 5SO3↑ + 3SO2↑ + 53H2O,将产生的气体通过如右图所示的装置。则集气瓶中收集到的气体是 (填化学式)。
+ N2↑ + 5SO3↑ + 3SO2↑ + 53H2O,将产生的气体通过如右图所示的装置。则集气瓶中收集到的气体是 (填化学式)。
【答案】(1)AlN+3H2O![]() Al(OH)3+NH3↑;降低NH3在水中的溶解度,促使NH3逸出;
Al(OH)3+NH3↑;降低NH3在水中的溶解度,促使NH3逸出;
(2)Al2O3+6H+═2Al3++3H2O;(3)2Fe2++2H++ClO-═2Fe3++Cl-+H2O;
(4)Fe(OH)3;(5)防止Al(OH)2Cl水解生成Al(OH)3(6)N2
【解析】
试题分析:分析工艺流程和信息知向铝灰(主要成分为Al、Al2O3、AlN、FeO等)中加水,90℃时,AlN水解生成氢氧化铝和氨气,然后加入盐酸酸溶,所得溶液为氯化铝、氯化亚铁和盐酸的混合液,加入漂白液,将Fe2+氧化为Fe3+,加入碳酸钠,Fe3+转化为氢氧化铁沉淀而除去,喷雾干燥得到产品。
(1)根据题意知气体A能使湿润的红色石蕊试纸变蓝,则A为氨气,则铝灰中AlN在90 ℃水解生成氢氧化铝和氨气,化学方程式为AlN+3H2O![]() Al(OH)3+NH3↑;“水解”采用90℃而不在室温下进行的原因是降低NH3在水中的溶解度,促使NH3逸出。
Al(OH)3+NH3↑;“水解”采用90℃而不在室温下进行的原因是降低NH3在水中的溶解度,促使NH3逸出。
(2)“酸溶”时,Al2O3与盐酸反应生成氯化铝和水,离子方程式为Al2O3+6H+═2Al3++3H2O。
(3)“氧化”时,溶液中的Fe2+在酸性条件下被漂白液中的ClO-氧化为Fe3+,发生反应的离子方程式为2Fe2++2H++ClO-═2Fe3++Cl-+H2O 。
(4)“废渣”成分为Fe(OH)3。
(5)采用喷雾干燥而不用蒸发的原因是防止Al(OH)2Cl水解生成Al(OH)3。
(6)缺少实验装置图,无法解析。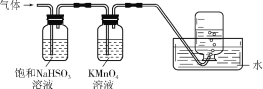


科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是

A.d极为阴极
B.放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-=PbSO4+2H2O
C.若四个电极材料均为石墨,当析出6.4gCu时,消耗H2SO40.2mol
D.甲池中阳离子向b极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的水溶液: ①NaOH ②CH3COOH ③NH3 ④NaHCO3⑤Cl2 不能溶解CaCO3的是
A. ①③④ B. ①④⑤ C. ②④ D. ②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲容器容积不变,乙容器有可移动活塞。甲中充入3 molA和2 moI B,乙中充入2 molC和2 mol D,发生反应:3A(g)+2B(s)![]() C(g)+D(g) △H >0。在相同温度下反应达到平衡,活塞移动到4处。下列有关说法正确的是( )
C(g)+D(g) △H >0。在相同温度下反应达到平衡,活塞移动到4处。下列有关说法正确的是( )

A.平衡后,容器内压强:P甲<P乙
B.平衡后,若向乙中再加入B物质,活塞向右移动
C.平衡后,若将活塞移动至3处,乙中c(A)、c(D)均增大
D.同时升高相同温度,达到新平衡时,甲中A物质的速率等于乙中A物质的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:__________。
②某元素原子的最外层电子数等于次外层电子数:__________________ 。
③L 层电子数是M层电子数2倍的元素: ___________________ 。
④某同位素原子核内没有中子的元素: ___________________ 。
(2)写出1~18号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。
①某元素原子L层上的电子数为K层的3倍: __________________ 。
②某元素原子L层上的电子数为K层的一半: _________________ 。
③得到2个电子后,电子总数与氩原子的电子总数相同的离子: ___________________ 。
④某元素原子的最外层电子数等于次外层电子数的2倍: ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+ Y(g)![]() Z(g)+W(s) △H>0;下列叙述正确的是( )
Z(g)+W(s) △H>0;下列叙述正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.若升高温度,平衡向逆反应方向移动
D.平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应一定属于吸热反应的是 ( )
A. 酸碱中和反应
B. 需要加热的反应
C. 化学键断裂吸收的能量比化学键形成放出的能量少的反应
D. 氢氧化钡晶体和氯化铵晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1 min内的平均速率为:v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com