
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1 min内的平均速率为:v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
【答案】B
【解析】
试题分析:A.v(CO)= =
=![]() mol/(Lmin),化学反应速率之比等于化学计量数之比,则v(H2)=v(CO)=
mol/(Lmin),化学反应速率之比等于化学计量数之比,则v(H2)=v(CO)=![]() mol/(Lmin),故A错误; B.CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故B正确;C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C错误;D.t1min时反应已经达到平衡状态,此时c(CO)=
mol/(Lmin),故A错误; B.CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故B正确;C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C错误;D.t1min时反应已经达到平衡状态,此时c(CO)=![]() =0.4mol/L,c(H2O)=
=0.4mol/L,c(H2O)=![]() =0.1mol/L,c(CO2)=c(H2)=
=0.1mol/L,c(CO2)=c(H2)=![]() =0.2mol/L,则k=
=0.2mol/L,则k=![]() =1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D错误;故选B
=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D错误;故选B


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:

(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为 ;“水解”采用90℃而不在室温下进行的原因是 。
(2)“酸溶”时,Al2O3发生反应的离子方程式为 。
(3)“氧化”时,发生反应的离子方程式为________________________________。
(4)“废渣”成分为______________(填化学式)。
(5)采用喷雾干燥而不用蒸发的原因是______________________。
(6)煅烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3 + 2NH3↑
2Al2O3 + 2NH3↑ + N2↑ + 5SO3↑ + 3SO2↑ + 53H2O,将产生的气体通过如右图所示的装置。则集气瓶中收集到的气体是 (填化学式)。
+ N2↑ + 5SO3↑ + 3SO2↑ + 53H2O,将产生的气体通过如右图所示的装置。则集气瓶中收集到的气体是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应aA(g)+bB(g)![]() cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )

A.T1<T2,P1<P2,a+b>c,Q<0
B.T1>T2,P1<P2,a+b<c,Q>0
C.T1<T2,P1>P2,a+b<c,Q>0
D.T1<T2,P1>P2,a+b>c,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1.01×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ·mol-1
B.H2O(g)=H2(g)+![]() O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
C.H2(g)+![]() O2(g)=H2O(g) ΔH=-484kJ·mol-1
O2(g)=H2O(g) ΔH=-484kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学反应能量变化相关的叙述正确的是( )
A.反应物总能量低于生成物总能量时,该反应一定不能发生
B.化学键的键能越大,物质的能量越高
C.一个反应的焓变因反应物的用量和反应条件的改变而发生改变
D.应用盖斯定律,可计算某些难以直接测量的反应焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其主要的化合物在化学研究及生产生活中都有重要的应用。
(1)硫的气态氢化物H2S是一种臭鸡蛋气味的气体,写出它的电子式 ,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明H2S有强的 性。
(2)硫单质在一定条件下能与硫化钠反应分别生成多硫化钠(与Na2O2结构相似),反应方程式为:Na2S+(x-1)S=Na2Sx
①Na2Sx中所合化学键的类型有 。
②已知向多硫化钠溶液中滴加稀盐酸,溶液变浑浊,且有臭鸡蛋气味的气体生成,写出发生反应的离子方程式: 。
(3)硫代硫酸钠(Na2S2O3)俗名叫大苏打,在中学化学实验中利用它和稀硫酸的反应探究温度对化学反应速率的影响。
①写出Na2S2O3与稀硫酸反应的化学方程式: 。
②S2O32-有很强的配位能力,照相底片上未曝光的溴化银在定影液(含Na2S2O3)中由于形成一个配位数为2的配离子而溶解,该配离子的化学式为: 。
(4)锅炉水垢中的硫酸钙因难溶于酸而很难清洗,通常采取的方法为先用饱和碳酸钠溶液处理,再用稀盐酸除去;写出用饱和碳酸钠溶液处理时发生反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g) ![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是 ( )
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是 ( )
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() x mol
x mol
A.① B.①② C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1) Zn2+在基态时核外电子排布式为 。
(2) SO42-的空间构型是 (用文字描述)。
(3) PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3, CH2=CH-CHO, HCOOH, CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是 。
a.N2O结构式可表示为N=N=O
b.O3分子呈直线形
c.CH2=CH-CHO分子中碳原子均采用sp2杂化
d.相同压强下HCOOH沸点比CH3OCH3高,说明前者是极性分子后者是非极性分子
②1mo1PAN中含σ键数目为 。
③NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]S04,该配合物中心离子的配位数为 (填数字).
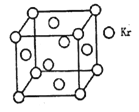
(4)测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n= (填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。
如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-)。

(1)d电极的名称为___________,d电极上的电极反应式为____________________
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1 AgNO3溶液,a电极上的电极反应式为___________,若a电极产生560mL(标准状况)气体,则所得溶液的C(H+)=___________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入_________(填序号)其物质的量为_______mol
a Ag2O b.AgOH c.AgNO3 d.Ag2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com