
【题目】硫及其主要的化合物在化学研究及生产生活中都有重要的应用。
(1)硫的气态氢化物H2S是一种臭鸡蛋气味的气体,写出它的电子式 ,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明H2S有强的 性。
(2)硫单质在一定条件下能与硫化钠反应分别生成多硫化钠(与Na2O2结构相似),反应方程式为:Na2S+(x-1)S=Na2Sx
①Na2Sx中所合化学键的类型有 。
②已知向多硫化钠溶液中滴加稀盐酸,溶液变浑浊,且有臭鸡蛋气味的气体生成,写出发生反应的离子方程式: 。
(3)硫代硫酸钠(Na2S2O3)俗名叫大苏打,在中学化学实验中利用它和稀硫酸的反应探究温度对化学反应速率的影响。
①写出Na2S2O3与稀硫酸反应的化学方程式: 。
②S2O32-有很强的配位能力,照相底片上未曝光的溴化银在定影液(含Na2S2O3)中由于形成一个配位数为2的配离子而溶解,该配离子的化学式为: 。
(4)锅炉水垢中的硫酸钙因难溶于酸而很难清洗,通常采取的方法为先用饱和碳酸钠溶液处理,再用稀盐酸除去;写出用饱和碳酸钠溶液处理时发生反应的离子方程式: 。
【答案】
(1)![]() ;还原性
;还原性
(2)①离子键 非极性共价键,②Sx2-+2H+=H2S↑+(x-1)S↓
(3)①Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O②[Ag(S2O3)2]3-
(4)CaSO4+CO32-=CaCO3+SO42-
【解析】
试题分析:(1)H2S属于共价化合物,它的电子式为![]() ,H2S的水溶液在空气中放置时,容易被空气中的氧气氧化生成硫单质沉淀,逐渐变浑浊,说明H2S有较强的还原性,故答案为:
,H2S的水溶液在空气中放置时,容易被空气中的氧气氧化生成硫单质沉淀,逐渐变浑浊,说明H2S有较强的还原性,故答案为:![]() ;还原性;
;还原性;
(2)①Na2Sx属于离子化合物,含有离子键,阴离子中含有非极性共价键,故答案为:离子键 非极性共价键;
②向多硫化钠溶液中滴加稀盐酸,溶液变浑浊,且有臭鸡蛋气味的气体生成,说明生成了硫和硫化氢,反应的离子方程式为Sx2-+2H+=H2S↑+(x-1)S↓,故答案为:Sx2-+2H+=H2S↑+(x-1)S↓;
(3)①Na2S2O3与稀硫酸发生歧化反应,反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,故答案为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O;
②S2O32-有很强的配位能力,照相底片上未曝光的溴化银在定影液(含Na2S2O3)中由于形成一个配位数为2的配离子而溶解,该配离子的化学式为[Ag(S2O3)2]3-,故答案为:[Ag(S2O3)2]3-;
(4)溶解度大的可转化为溶解度小的物质,锅炉水垢中的硫酸钙可用碳酸钠饱和溶液处理,使之转化为碳酸钙,碳酸钙能与稀盐酸反应CaCO3+2HCl═CaCl2+H2O+CO2↑,生成可溶性的氯化钙除去,用饱和碳酸钠溶液处理时反应的离子方程式为CaSO4+CO32-=CaCO3+SO42-,故答案为:CaSO4+CO32-=CaCO3+SO42-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(1)探究FeSO4溶液的酸碱性:取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和 。
A.玻璃棒 B.试管 C.天平 D.量筒
(2)利用下图装置探究FeSO4的稳定性
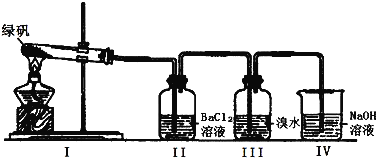
①II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是 。
A.Fe2O3 、SO3 、H2O
B.Fe2O3 、SO2 、SO3 、H2O
C.FeO 、Fe2O3 、SO2 、SO3 、H2O
②III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是 。
③NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式: 。
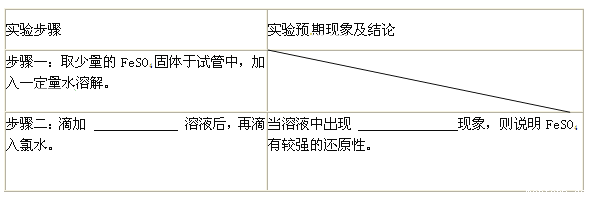
(3)探究FeSO4中Fe2+还原性:
证明FeSO4有较强的还原性,完成下表。
(4)硫酸亚铁用途探究
缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1 min内的平均速率为:v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 设NA为阿伏伽德罗常数值。下列有关叙述不正确的是
A.将1molCl2溶入足量的水中,溶液里HClO、Cl-、ClO-粒子数之和为2NA
B.3.4g NH3中共用电子对数为0.6NA
C.相同质量的N2和CO所含有的分子数、原子总数、电子总数都相等
D.标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池和电解池的叙述正确的是( )
A.原电池中失去电子的电极为正极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阴极一定是阴离子放电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8 g该有机物燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的C≡C键,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是 ,A的结构简式是
(2)有机物B是A的同分异构体,1 mol B可与1 mol Br2加成。该有机物中所有碳原子在同一个平面上,没有顺反异构现象。B的结构简式是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com