
【题目】科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。
如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-)。

(1)d电极的名称为___________,d电极上的电极反应式为____________________
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1 AgNO3溶液,a电极上的电极反应式为___________,若a电极产生560mL(标准状况)气体,则所得溶液的C(H+)=___________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入_________(填序号)其物质的量为_______mol
a Ag2O b.AgOH c.AgNO3 d.Ag2SO4
【答案】
(1)负极;CH4+4O2--8e-=CO2+2H2O
(2)4OH--4e- =2H2O+O2↑;1mol/L;a;0.05mol
【解析】
试题分析:(1)图甲是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极,甲烷失电子发生还原反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子,负极电极反应为:CH4+4O2--8e-═CO2+2H2O;故答案为:负极;CH4+4O2--8e-═CO2+2H2O;
(2)如图乙所示电解100mL0.5molL-1 AgNO3溶液,发生的电解池反应为:4AgNO3+4H2O![]() 4Ag+O2↑+4HNO3,与电源正极相连的为阳极,溶液中氢氧根离子失去电子发生氧化反应,电极反应为:4OH--4e- = 2H2O+O2↑;若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=
4Ag+O2↑+4HNO3,与电源正极相连的为阳极,溶液中氢氧根离子失去电子发生氧化反应,电极反应为:4OH--4e- = 2H2O+O2↑;若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=![]() =0.1mol/L;则所得溶液电解过程中AgNO3溶液每损失4个Ag原子,就损失2个 O原子,相当于损失一个Ag2O,为了使AgNO3溶液,恢复原浓度,应加入Ag2O,故选a;电解过程中生成氧气0.0025mol,因此加入Ag2O的物质的量为0.05mol,故答案为:4OH--4e- =2H2O+O2↑;1mol/L;a;0.05mol。
=0.1mol/L;则所得溶液电解过程中AgNO3溶液每损失4个Ag原子,就损失2个 O原子,相当于损失一个Ag2O,为了使AgNO3溶液,恢复原浓度,应加入Ag2O,故选a;电解过程中生成氧气0.0025mol,因此加入Ag2O的物质的量为0.05mol,故答案为:4OH--4e- =2H2O+O2↑;1mol/L;a;0.05mol。


科目:高中化学 来源: 题型:
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1 min内的平均速率为:v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol – 1,甲元素的原子最外层电子数与K层电子数相等,E的水溶液显碱性,K为乙元素的单质。C为单质,其原子在周期表中半径最小。D为气体,对空气的相对密度为1.103。在适当的条件下,它们相互之间有如下图所示的转化关系:

试填写下列空白:
(1)甲元素的单质在空气中燃烧产物除了得到A外,还可得到_____________,物质F的电子式为____________。
(2)反应“E+D→G+B”是制硝酸工业中的重要反应之一,其方程式为______________“E+CuO”的化学方程式为_________________
(3)C和D还能在一定条件下反应生成另一种化合物I,I与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)电源B极的名称是________。
(2)如果收集乙装置中两极产生的气体,两极气体的物质的量之比是________。
(3)甲装置中电解反应的总化学方程式:_______________________。
(4)欲用丙装置给铁镀锌,G应该是_______(填“铁”或“锌”),电镀液的主要成分是_______(填化学式)。
(5)装置丁中的现象是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,化合物![]() 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
C.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段为 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8 g该有机物燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的C≡C键,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是 ,A的结构简式是
(2)有机物B是A的同分异构体,1 mol B可与1 mol Br2加成。该有机物中所有碳原子在同一个平面上,没有顺反异构现象。B的结构简式是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 工业上可通过CO和H2化合制得CH3OH: CO(g)+2H2(g) ![]() CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
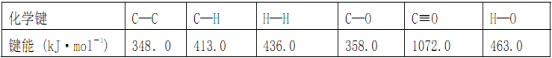
则ΔH =_____________,在相应的反应条件下,将 1 mol CO(g)与足量H2混合充分反应后,则放出或吸收的热量Q ________ ΔH 的数值(填“>”、“=”或“<”)。
Ⅱ.电化学降解NO3-的原理如右图所示。

①电源 A 极为________(填“正极”或“负极”),阴极反应式为_______________。
②若电解过程中转移了 1 mol 电子,则膜左侧电解液的质量减少量为________g。
Ⅲ.已知NO2和N2O4的相互转化反应:2NO2(g)![]() N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:

①图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化。下列不能说明该反应已达到平衡状态的是________。
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均分子量不随时间变化而改变
②前 10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min)。
③反应 25 min 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_____________(用文字表达);其平衡常数 K(d)________K(b)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们经常食用的牛、羊、猪等肉类和白菜、土豆等蔬菜,经消化吸收后,其中的成分可被转化为人体的组成成分。对以上事实解释合理的是
A. 组成生物体细胞的化学元素在无机自然界都能找到
B. 不同生物的细胞内,组成它们的化学元素含量大体相同
C. 组成生物体细胞的生物大分子都是以碳链作为骨架
D. 不同生物的细胞内,组成它们的化学元素种类大体相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)反应的平衡常数表达式K=_____________;根据下图,升高温度,K值将__________(填“增大”、“减小”或“不变”)。
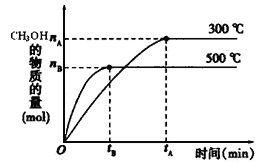
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是____________ (填字母)。
a.v生成(CH3OH)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(填字母)___________________。
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com