
用已知物质的量浓度的盐酸滴定未知物质的量浓度的NaOH溶液时,下列操作中不正确的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸
B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知物质的量浓度的NaOH溶液
C.滴定前,要排除滴定管尖嘴处的气泡
D.读数时,视线与滴定管内液体凹液面最低处保持一致
科目:高中化学 来源: 题型:
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式为_________________________。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程为:
①用托盘天平称量NH4Al(SO4)2·12H2O固体______________________g;
②将上述固体置于烧杯中,_________________________。
(3)在0.1 mol·L-1 NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图:
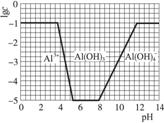
①用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有___________。
②请在答题卡的框图中,画出0.01 mol·L-1 NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图,并进行必要标注。
查看答案和解析>>
科目:高中化学 来源: 题型:
1995年三位美国科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,由图可知( )
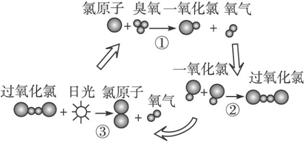
A.日光在反应中作催化剂
B.过氧化氯是一种很稳定的物质
C.过氧化氯的结构式为O—Cl—Cl—O
D.臭氧分子最终转变成氧气分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关比色法测样品纯度的说法正确的是( )
A.比色法的优点是灵敏度高,缺点是误差较大
B.无色金属离子都不能用比色法测定
C.酸性溶液中的H+的显色剂可用酚酞代替石蕊
D.配制抗贫血(含Fe2+)药片样品溶液,加入硝酸的目的是防止Fe2+水解
查看答案和解析>>
科目:高中化学 来源: 题型:
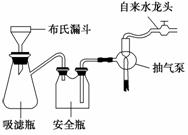
某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
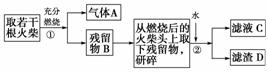
请回答以下问题:
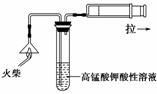
(1)为验证气体A,按如图所示装置进行实验:若能观察到______的现象,即可证明火柴头上含有S元素。
(2)步骤②的实验操作装置如图所示,该操作的名称是________,其工作原理是____________________________。
(3)要证明火柴头中含有Cl元素的后续实验步骤是
_____________________________________________。
(4)有学生提出检验火柴头上KClO3的另一套实验方案:

有关的离子方程式为________,
有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是______________________________________________。
(5)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验。
| 实验次数 | H2O2溶液质量分数/% | H2O2溶液用量/mL | 物质D用量/g | 反应温度/℃ | 收集气体体积/mL | 所需时间/s |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验________和________能证明物质D的用量越大,反应速率越快。
(6)写出步骤①中发生反应的化学方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
⑴下列措施中,有利于降低大气中CO2浓度的有: 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
⑵将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O C6H12O6
C6H12O6
b.CO2 + 3H2 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4 CH3COOH
CH3COOH
d.2CO2 + 6H2 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
⑶文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
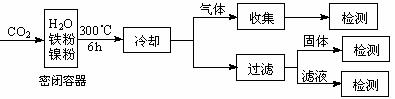
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,
即:CO2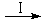 HCOOH
HCOOH CH4
CH4
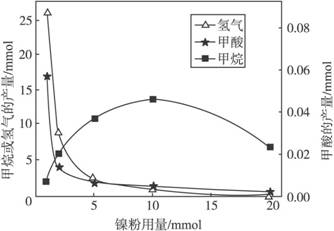
①写出产生H2的反应方程式 。
②由图可知,镍粉是 。(填字母)
a.反应Ⅰ的催化剂
b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂
d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是 。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是______________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是___________________,此液体具有的性质是______(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为________。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com