
【题目】下列离子方程式正确的是( )
A.NH3·H2O在水中的电离:NH3·H2O=NH4++OH
B.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32-
+CO32-
C.FeCl3溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
D.碳酸氢钙溶液中加少量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是
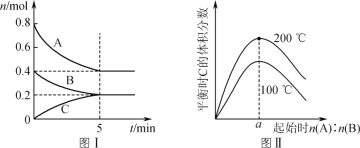
A.200 ℃时,反应达平衡时的平均速率v(B)=0.002 mol·(L·min)-1
B.图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧、硫、硒(Se)、碲(Te)、钋(Po)是元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1)硒在元素周期表中的位置________。
(2)![]() Po的中子数为________。
Po的中子数为________。
(3)某温度时,该族单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+2H2(g)=2H2O(g) △H1=-484 kJ/mol
S(g)+H2(g)![]() H2S(g) △H2=-20 kJ/mol
H2S(g) △H2=-20 kJ/mol
Se(g)+H2(g)![]() H2Se(g) △H3=+81kJ/mol
H2Se(g) △H3=+81kJ/mol
①硫和硒氢化物的热稳定性:H2S________ H2Se(填“>”、“=”或“<”);判断依据是________。
②写出O2(g)与H2S(g)反应生成H2O(g)和S(g)的热化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
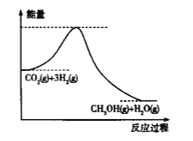
【题目】缓解当前能源和资源紧张问题的方法无非是开源和节流两个方面,从开源角度看,有效地开发利用燃煤产生的CO2重新合成新的燃料是一个途径,目前工业上用CO2来生产甲醇的原理是CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
(1)上述反应过程中的能量变化如图所示,该反应是_____________(填“吸热”或“放热”)反应。
(2)一定温度下,将5molCO2和8molH2充入2L恒容密闭容器中发生上述反应,测得H2的物质的量与时间的关系如图所示,
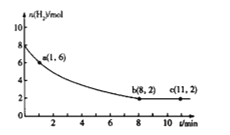
0-1min内,用CO2表示的平均反应速率v(CO2)=________________(保留两位有效数字);a点的逆反应速率________________b点的逆反应速率(填“>”“<”或“=”)。
(3)对于在恒温恒容条件下进行的反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下列叙述不能说明其已达到平衡状态的是________________(填序号)。
CH3OH(g)+H2O(g),下列叙述不能说明其已达到平衡状态的是________________(填序号)。
a. 混合气体的密度不再改变
b. 容器内的压强不再发生变化
c. CH3OH(g)的浓度保持不变
d. 单位时间内消耗1molCO2,同时生成1molCH3OH
(4)甲醇燃料电池是一种高效、环境友好的发电装置,结构如图所示(电解质溶液为稀硫酸):

①Pt(b)电极上发生_____________(填“氧化”或“还原”)反应,电极反应式为________________________。
②如果该电池工作时导线中通过3mol电子,则理论上消耗甲醇的物质的量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示,下列说法不正确的是( )

A.等量金刚石和石墨完全燃烧,金刚石放出热量更多
B.在通常状况下,石墨比金刚石更稳定
C.12g石墨在一定量空气中燃烧,生成气体36g,生成的气体为CO与CO2混合物
D.2C(石墨,s)+O2(g)=2CO(g) △H=-110.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把二氧化硫通入硝酸铁溶液中,溶液由黄色变为浅绿色,但立即又变为黄色,此时若滴入氯化钡溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是( )
A.SO2B.NO3-C.Fe3+D.Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )
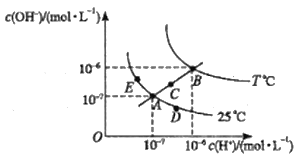
A.图中五点Kw间的关系B>C>A=D=E
B.若从A点到C点,可采用温度不变在水中加入适量的NH4Cl固体
C.若从A点到D点,可采用温度不变在水中加入少量的酸
D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸胺(H2NCOONH4)固体,置于特制密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使反应: H2NCOONH4(s)![]() 2NH3(g)+CO2(g)达到分解平衡,实验测得不同温度及反应时间(t1<t2<t3)的有关表格:
2NH3(g)+CO2(g)达到分解平衡,实验测得不同温度及反应时间(t1<t2<t3)的有关表格:
氨基甲酸铵分解时温度、气体总浓度及反应时间的关系。
温度/℃ 气体总浓度(mol/L) 时间/min | 15 | 25 | 35 |
0 | 0 | 0 | 0 |
t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
(1)在25℃,0-t1时间内产生氨气的平均速率为___。
(2)根据表中数据换算出,15℃时合成反应2NH3(g)+CO2(g)![]() H2NCOONH4(s)平衡常数K约为___。
H2NCOONH4(s)平衡常数K约为___。
(3)以捕捉到的CO2与H2为原料可合成甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)![]() CH3OH(g)+H2(g) ΔH<0在恒温恒容的密闭容器中,加入1molCO2和3molH2,充分反应达平衡时放出热量akJ,若在原容器中加入2molCO2和6molH2,在相同温度下反应达平衡时放热bkJ,则a和b满足的关系___。
CH3OH(g)+H2(g) ΔH<0在恒温恒容的密闭容器中,加入1molCO2和3molH2,充分反应达平衡时放出热量akJ,若在原容器中加入2molCO2和6molH2,在相同温度下反应达平衡时放热bkJ,则a和b满足的关系___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________。
(2)滤渣1的主要成分除SiO2外还有___________;氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回_______工序继续使用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com