
【题目】水的电离平衡曲线如图所示。下列说法正确的是

A.图中对应点的温度关系为a>b>c
B.纯水仅升高温度,可从a点变到c点
C.水的离子积常数KW数值大小关系为b>c>d
D.在b点对应温度下,0.5 mol/L的H2SO4溶液与1 mol/L的KOH溶液等体积混合,充分反应后,所得溶液的pH=7
【答案】C
【解析】
A.温度越高,水的离子积常数越大,根据图象知,b点Kw=10-12,c点Kw=10-13,a点Kw=10-14,所以b>c>a,选项A错误;
B.c点Kw=10-13,则c曲线的纯水中6<pH<7,c点的pH=6,则该溶液呈酸性,所以纯水仅升高温度,不能从a点变到c点,选项B错误;
C.a、d曲线温度相同,则离子积常数相同,即d点Kw=10-14,b点Kw=10-12,c点Kw=10-13,所以水的电离常数KW数值大小关系为:b>c>d,选项C正确;
D.b点Kw=10-12,0.5mol/L的H2SO4溶液与1mol/L的KOH溶液等体积混合,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,pH=6,选项D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.1g 由CO 和H2 组成的混合气体,在足量的O2 充分燃烧后,立即通入足量的Na2O2 固体中,固体的质量增加
A.2.1gB.3.6gC.4.2gD.7.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:
3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
A.该反应的化学平衡常数表达式是K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,化学平衡常数增大
D.增加C,平衡时混合气体密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要且广泛的应用
(1)基态Fe2+的价层电子排布图为_____________
(2)检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下表:
元素 | Mn | Fe | |
电离能 |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
根据表中数据可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是___________________________。
(4)已知Fe单质有如图所示的两种常见堆积方式:


其中属于体心立方密堆积的是______填“a”或“b”;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol/L的硫酸于试管中② | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为____________________
(2)甲同学的实验目的是:在相同的温度下,__________________________________。
实验二:乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是______________________;该实验中不选用某浓度的硫酸,理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为2K2S2+KI3![]() K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是![]() ( )
( )
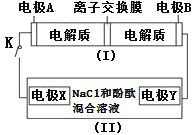
A.闭合K时,K+从左到右通过离子交换膜
B.闭合K时,电极X是阳极
C.闭合K时,电极A的反应式为3I--2e-=I3-
D.闭合K时,当有0.1molK+通过离子交换膜,X电极上产生气体2.24L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com