
【题目】在一密闭容器中,充入一定量的反应物A,反应![]() 达平衡后,保持温度不变,将容器体积缩到一半,当达到新的平衡时,B的浓度是原来的1.6倍,则下列判断正确的是( )
达平衡后,保持温度不变,将容器体积缩到一半,当达到新的平衡时,B的浓度是原来的1.6倍,则下列判断正确的是( )
A. ![]() B. 物质A的转化率降低
B. 物质A的转化率降低
C. 物质B的质量增加 D. 平衡向正反应方向移动了
科目:高中化学 来源: 题型:
【题目】对下列实验的描述不正确的是

A. 图(a)根据检流计(G)中指针偏转的方向比较Zn、Cu 的金属活泼性
B. 图(b)根据导管中液面的变化判断铁钉发生了析氢腐蚀
C. 图(c)根据温度计读数的变化测定稀HCl和稀NaOH溶液的反应热
D. 图(d)根据两只烧瓶中气体颜色的变化判断2NO2(g)![]() N2O4(g)的热效应
N2O4(g)的热效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程(如下图),流程中的滤液经过多次循环后用来后续制备氧化铁粉末。

(1)为了加快反应①的反应速率,除了搅拌、适当升高温度、将硫酸渣粉碎外还可采用的措施是____________________________(写出一点即可)。
(2)反应②主要作用是“还原”,即将Fe3+转化为Fe2+。在温度T1、T2(T1>T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如下图所示.得出结论:该反应的温度不宜过高。

①已知信息:pH= -lgc(H+),如0.1mol/L的盐酸的pH= -lg0.1=1。在上述流程中通入SO2气体“还原”时,试用离子方程式和适当文字来解释pH下降的原因是__________________________;
②相同时间内,T1温度下,溶液的pH更高的原因是____________________________________。
(3)该流程中循环使用的物质是 _____________。
(4)现有一包固体FeO和Fe2O3,欲要化学方法确定其中含有氧化亚铁,应选择的试剂是________。(填选号字母)
A. 盐酸、硫氰化钾溶液 B. 稀硫酸、酸性高锰酸钾溶液
C. 稀硫酸、硫氰化钾溶液 D. 稀硝酸、硫氰化钾溶液
(5)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。已知:2Na2S2O3 + I2 = Na2S4O6 + 2NaI,试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。
2PbSO4+2H2O。

(1)放电时,正极的电极反应式是___________________________,电解液中H2SO4的浓度逐渐________________,当外电路通过1mol电子时,理论上负极板的质量增加________________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接电解,则在A电极的电极反应式是___________________, B电极的电极反应式是____________________,电解后铅蓄电池的正、负极的极性将______________ (填“改变”或“不改变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
增大
C. 向盐酸中加入氨水至中性,溶液中 >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中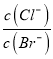 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:
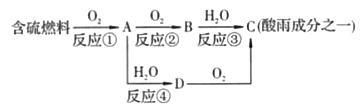
回答下列问题:
①酸雨的pH________(填“>”“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为___________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:____________,反应中氧化剂是___________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g)ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A. 图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻加入催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
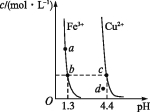
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
C.加适量NH4Cl固体可使溶液由a点变到b点
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是

A. X极是电源负极,Y极是电源正极
B. 电解过程中CuSO4溶液的pH逐渐增大
C. a极的电极反应是2Cl--2e-=Cl2↑
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com