
【题目】碳的化合物与人类生产、生活密切相关。
(1)标准状况下,将11.2LCO2通入100mL 1mol/L的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为___________;用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+______。
②c(H+)+c(Na+)=_________。
(2)下图是1mol NO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________

(3)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),
Ni(CO)4(g),![]() H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________ (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________ (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,![]() H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(4)二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):
①CH3OCH3(g)+H2O(l)![]() 2CH3OH(l) △H=+24.52kJ/mol
2CH3OH(l) △H=+24.52kJ/mol
②CH3OH(l)+H2O(l)![]() CO2(g)+3H2(g) △H=+49.01kJ/mol
CO2(g)+3H2(g) △H=+49.01kJ/mol
③CO(g)+H2O(l)![]() CO2(g)+H2(g) △H=-41.17kJ/mol
CO2(g)+H2(g) △H=-41.17kJ/mol
④CH3OH(l)![]() CO(g)+2H2(g) △H=+90.1kJ/mol
CO(g)+2H2(g) △H=+90.1kJ/mol
工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,


①你认为反应控制的最佳温度应为___________。
A.300~350℃ B.350~400℃ C.400~450℃ D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是___________(用相应的化学方程式表示)。
【答案】(1) c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+) ①c(H+)+c(HCO-3)
②2c(CO2-3)+c(HCO-3)+c(OH-)
(2) NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol-1
(3) C
(4)①C ②可能发生另一种重整制氢反应:CH3OCH3 +CO2 ![]() 3H2+3CO
3H2+3CO
【解析】(1)标准状况下,1.12L CO2的物质的量为:![]() =0.05mol,氢氧化钠的物质的量为:1molL-1×0.1L=0.1mol,二者恰好完全反应生成碳酸钠,由CO32-+H2OHCO3-+OH-可知:c(Na+)最大,水解很微弱,因此c(CO32-)>c(OH-)>c(HCO-3),溶液显碱性c(H+)最小,因此碳酸钠溶液中离子浓度大小顺序为:c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+);
=0.05mol,氢氧化钠的物质的量为:1molL-1×0.1L=0.1mol,二者恰好完全反应生成碳酸钠,由CO32-+H2OHCO3-+OH-可知:c(Na+)最大,水解很微弱,因此c(CO32-)>c(OH-)>c(HCO-3),溶液显碱性c(H+)最小,因此碳酸钠溶液中离子浓度大小顺序为:c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+);
①碳酸钠溶液中,水电离出的氢离子部分与CO32-结合生成H2CO3和HCO3-,溶液中质子守恒:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+);
②碳酸钠溶液中,电荷守恒:c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-);
(2)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJmol-1;
(3)A.Ni是固体,浓度为常数,改变用量对平衡无影响,反应物的转化率不变,故A错误;B.一定温度下给定的化学方程式的△H不会随着平衡移动而改变,只与方程式的书写方式有关,故B错误;C.因外界条件为恒温恒容、Ni是固体且正反应为气体体积缩小的反应,所以反应达到平衡后充入CO,相当于在恒温恒压条件下达平衡后又加压,平衡右移,CO的转化率提高,平衡后其体积分数降低,故C正确;D.速率关系未说明正、逆,不能判断是否已达平衡;因该反应气体质量增加而容积不变,所以混合气体密度是一个变量,当不变时说明反应达平衡,故D错误;故答案为C;
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,故答案为C;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2![]() 3H2+3CO。
3H2+3CO。


科目:高中化学 来源: 题型:
【题目】20℃时向10mL0.1mol·L-1醋酸溶液中不断滴入0.1mol·L-1NaOH溶液,溶液pH变化如图所示。此过程里溶液中离子浓度的关系错误的是
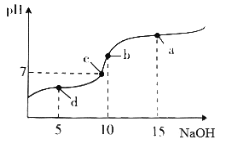
A. a点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点: c(H+)= c(CH3COOH)+c(OH-)
C. c点:c(Na+)= c(CH3COO-)>c(H+)=c(OH-)
D. d点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.碱石灰具有吸水性,可用于干燥氯气
B.甲醛能使蛋白质变性,可以用于食品防腐剂
C.炭具有强还原性,常用于冶炼钠、钾等金属
D.碳酸氢钠溶液具有弱碱性,可用于制胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,原子最外电子层只有2个电子的元素是
A. 无法判断是哪一类元素 B. 一定是稀有气体元素
C. 一定是过渡元素 D. 一定是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.氢氧化钠溶液与盐酸反应:OH﹣+H+=H2O
C.氯气与水反应:Cl2+H2O═2H++Cl﹣+ClO﹣
D.氯化钡溶液与稀硫酸反应:Ba2++SO42﹣=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:![]()
已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
则反应I的热化学方程式为________________。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) △H>0,请你分析该设想能否实现?______(填“是”或“否”) ,依据是_____________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
① 甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因___________。
② 向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,混合液呈______性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为______________。
(4)活性炭也可用于处理汽车尾气中的NO。在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:

①该反应的正反应为________(填”吸热”或“放热”)反应。
② 200℃时,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量将_____。(填“增大”、“减小”或“不变”)。
③计算反应体系在335℃ 时的平衡常数_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 盐析可提纯蛋白质并保持其生理活性
B. 油脂碱性或者酸性条件下的水解反应叫做皂化反应
C. 打针时用75%的乙醇溶液消毒是蛋白质变性知识的应用
D. 蛋白质、纤维素、淀粉都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B.需要通过化学反应才能从海水中获得食盐和淡水
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.粗硅制备单晶硅涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的俗称和所属类别均不正确的是
选项 | 化学式 | 俗称 | 类别 |
A | C2H6O | 酒精 | 有机物 |
B | NaOH | 苛性钠 | 碱 |
C | Na2CO3 | 烧碱 | 碱 |
D | NaHCO3 | 小苏打 | 盐 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com