
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
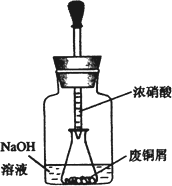
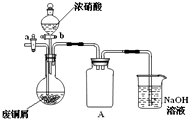
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品.
完成下列填空:
1.写出浓硝酸与铜反应的离子方程式.
2.上图装置中NaOH溶液的作用是________.反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有________(填写化学式).
3.步骤二中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外);洗涤的目的是________.
4.步骤二的滤液中可能含有CO32-,写出检验CO32-的方法.
5.影响产品产量的主要因素有________.
6.若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是________.
[答案]1.Cu+4H++2NO3-→Cu2++2NO2↑+2H2O(2分)
2.吸收氮氧化物(合理即给分);NaNO3、NaNO2(2分)
3.烧杯、温度计;除去产品表面吸附的硝酸钠(3分)
4.取样,加入稀盐酸,将产生的气体通入澄清石灰水,溶液变浑浊,说明有CO32-.(1分)
5.温度、pH(2分)
6.0.92(2分)
[解析](2)广口瓶内铜与浓硝酸反应生成大气污染气体NOx,NaOH溶液可用来吸收NOx,利用NO2+NaOH→NaNO2+NaNO3+H2O可知,反应结束后,广口瓶的溶液中,除了剩余的NaOH外,还含有新生成的NaNO2与NaNO3.(3)因反应器为大试管,故水浴加热中用来盛放水的仪器可以选用烧杯、温度计(测定水温);洗涤可除去碱式碳酸铜表面的吸附的硝酸钠.(5)由步骤2可知实验成功的关键是控制溶液PH和反应温度,故影响产品质量的主要因素为温度、PH.(6)碱式碳酸铜完全分解得到CuO,设样品中碱式碳酸铜的质量分数为x,依据碱式碳酸铜的方程式,利用“差量法”可得:222∶62=2.42x∶(2.42-1.80),解得x=0.92.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 22400w-65V |
| 64V |
| 22400w-65V |
| 64V |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁、铜和铝是人类生活中常用的金属.
铁、铜和铝是人类生活中常用的金属.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com