
【题目】下列事实能用勒夏特列原理解释的是
A.加入催化剂有利于合成氨的反应
B.由 H2(g)、I2(g)和 HI(g)组成的平衡体系加压后颜色变深
C.500 ℃时比室温更有利于合成氨的反应
D.光照新制的氯水时,溶液的 pH 逐渐减小
【答案】D
【解析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动;
使用勒夏特列原理时,研究对象必须为可逆反应,否则勒夏特列原理不适用;
催化剂只能改变反应速率,不会影响化学平衡,所以不能用勒夏特列原理解释。
A.催化剂只能同等程度地改变正逆反应速率,对化学平衡无影响,不能用勒夏特列原理解释,故A不选;
B.由H2、I2(g)、HI气体组成的平衡,反应前后气体体积不变,减压后平衡不动,体积增大颜色变浅,不能用勒夏特列原理解释,故B不选;
C.合成氨反应为放热反应,升高温度不利用平衡向正方向移动,但升温却可提高反应速率,不可用勒夏特列原理解释,故C不选;
D. 光照新制的氯水时,2HClO![]() 2HCl+O2↑,Cl2+H2O
2HCl+O2↑,Cl2+H2O![]() HClO+HCl,平衡正向移动,溶液的 pH 逐渐减小,可以用平衡移动原理解释,故D选;
HClO+HCl,平衡正向移动,溶液的 pH 逐渐减小,可以用平衡移动原理解释,故D选;
故选D。


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请设计实验,得出正确结论。
(1)提出问题:
氯水中何种物质能使湿润的红色布条褪色?
(2)收集资料:
①氯气有强氧化性
②氯气与水反应生成盐酸和次氯酸
③次氯酸有强氧化性
(3)提出假设:
①__;
②__;
③___;
④水使红色布条褪色
(4)验证假设:
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色;
实验②:__;
实验③:把红色布条放在水里,布条不褪色。
(5)得出的实验结论__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数。已知①Al4C3与硫酸反应可生成CH4;②AlN溶于强酸产生铵盐,溶于强碱生成氨气(忽略NH3在强碱性溶液中的溶解);③该实验条件下的气体摩尔体积为Vm L/mol,实验装置如下(量气管为碱式滴定管改装)
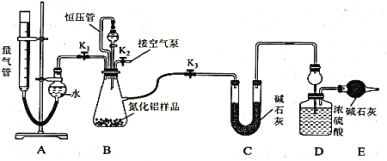
实验过程:连好装置后,检验装置的气密性;称得装置D的初始质量为ag;称取bg AlN样品置于装置B的锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管中液面的初始读数为x mL(量气装置左右液面相平)。
(1)①若先测量Al4C3质量分数,对K1、K2、K3三个活塞的操作是关闭活塞______,打开活塞______。
②当_____时,说明反应已经结束。读取读数之前,应对量气管进行的操作为____________;若量气管中的液面高于右侧球形容器中的液面,所测气体体积______(填“偏大”、“偏小”或“无影响”)。
③记录滴定管的读数为y mL,则Al4C3的质量分数为_________(用可能含a、b、x、y、Vm的代数式表示)。
④若无恒压管,对所测Al4C3质量分数的影响是______(填“偏大”、“偏小”或“无影响”)。
(2)若先测量AlN质量分数:首先关闭活塞K1,打开活塞K3,通过分液漏斗加入过量的某物质,写出AlN与过量的某物质发生反应的离子方程式为__________;反应完成后,__________(填该步应进行的操作),最后称得装置D的质量为cg,进而测量AlN的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2与H2反应生成NH3的过程中能量变化曲线如图所示。若在一个固定容积的密闭容器中充入1 mol N2和3 mol H2,使反应N2+3H2![]() 2NH3达到平衡,测得反应放出热量为Q1。
2NH3达到平衡,测得反应放出热量为Q1。
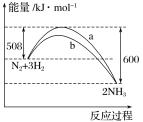
填写下列空白:
(1)Q1________92 kJ(填“>”“<”或“=”)。
(2)b曲线是________时的能量变化曲线。
(3)上述条件下达到平衡时H2的转化率为________。
(4)在温度体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则2Q1与Q2的关系为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧乙烷常用于一次性口罩生产过程中灭菌和新冠病毒的消杀,工业上常利用乙烯直接氧化法生产环氧乙烷(![]() ),发生的反应如下。
),发生的反应如下。
主反应Ⅰ:2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ΔH1=-210kJ·mol-1
(g) ΔH1=-210kJ·mol-1
副反应Ⅱ:CH2=CH2(g)+3O2(g)![]() 2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
副反应Ⅲ:2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g) ΔH3
4CO2(g)+4H2O(g) ΔH3
已知:环氧乙烷选择性是指乙烯进行反应Ⅰ生成环氧乙烷的优势。
(1)ΔH3=__kJ·mol-1。
(2)①图1是乙烯转化率、环氧乙烷选择性与流速关系的图象,图中随进料气的流速加快,乙烯的转化率下降,其可能原因是__。
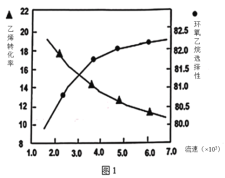
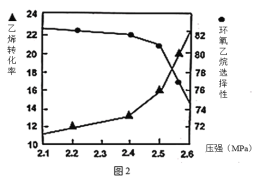
②图2是乙烯转化率、环氧乙烷选择性与压强关系的图象,图中当反应体系的压强高于2.4MPa,环氧乙烷选择性下降,其可能原因是__。
(3)实验测得反应Ⅰ中,υ正=K正·x2(CH2=CH2)·x(O2),υ逆=K逆·x2(![]() ),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
①若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,达到平衡时CH2=CH2的转化率为75%,则该反应平衡常数的值为__。
②若平衡后仅升高温度,则下列说法正确的是___。
A.x(CH2=CH2)增大,x(![]() )减小
)减小
B.K正与K逆的比值增大
C.υ正减小,υ逆增大
D.K正与K逆的比值减小
(4)将乙烯与饱和食盐水的电解产物反应,转化为氯乙醇[CH2(OH)CH2Cl],氯乙醇进一步反应生成环氧乙烷,其电解简易装置如图所示。
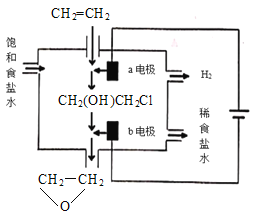
已知:CH2=CH2+H2O+Cl2→CH2(OH)CH2Cl+HCl
①a电极为__(选填“阴极”或“阳极”),其电极反应式为:__。
②b电极区域生成环氧乙烷的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次减小的短周期主族元素,已知W、Y、Z的最外层电子数之和等于X的最外层电子数;由四种元素形成某化合物的结构如图所示。下列叙述正确的是

A.简单氢化物的稳定性:Y>X
B.简单离子半径:X>W
C.Y的最高价氧化物对应水化物为强酸
D.该化合物中各元素均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
实验 序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=_________,T1=_______;通过实验___________可探究出温度变化对化学反应速率的影响。
(2)C组实验中液褪色时间t1______(填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = _________________。(用含有t1的式子表示)
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:______________。
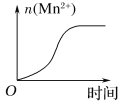
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com