
【题目】氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请设计实验,得出正确结论。
(1)提出问题:
氯水中何种物质能使湿润的红色布条褪色?
(2)收集资料:
①氯气有强氧化性
②氯气与水反应生成盐酸和次氯酸
③次氯酸有强氧化性
(3)提出假设:
①__;
②__;
③___;
④水使红色布条褪色
(4)验证假设:
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色;
实验②:__;
实验③:把红色布条放在水里,布条不褪色。
(5)得出的实验结论__。
【答案】氯气使红色布条褪色 次氯酸使红色布条褪色 盐酸使红色布条褪色 把红色布条伸入稀盐酸中,红色布条不褪色 次氯酸使红色布条褪色
【解析】
提出假设是根据收集到的资料结合所学知识进行的。氯气有氧化性,那么假设氯气使红色布条褪色,氯气和水生成盐酸和次氯酸,假设盐酸或次氯酸能使红色布条褪色,实验②把红色布条放到稀盐酸中,红色布条不褪色。氯水中的氯气、稀盐酸、水均不能使红色布条褪色,说明是次氯酸使红色布条褪色,据此分析;
(3)氯气溶于水发生Cl2+H2O ![]() HCl+HClO,含有成分是Cl2、HCl和HClO,能使红色布条褪色的假设可能是:假设一:氯气使红色布条褪色;假设二:盐酸使红色布条褪色;假设三:次氯酸使红色布条褪色;
HCl+HClO,含有成分是Cl2、HCl和HClO,能使红色布条褪色的假设可能是:假设一:氯气使红色布条褪色;假设二:盐酸使红色布条褪色;假设三:次氯酸使红色布条褪色;
答案为氯气使红色布条褪色;盐酸使红色布条褪色;次氯酸使红色布条褪色;
(4)实验①验证Cl2不能使红色布条褪色,实验③验证水不能使红色布条褪色,实验②验证的HCl不能使红色布条褪色,即把红色布条伸入稀盐酸中,红色布条不褪色;
答案为把红色布条伸入稀盐酸中,红色布条不褪色;
(5)根据上述分析,得出结论是次氯酸使红色布条褪色;
答案为次氯酸使红色布条褪色。


科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 2H2S+SO2=3S↓+2H2O中,氧化产物和还原产物物质的量之比为2:1
B. 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2
C. 3I2+6KOH![]() 5KI+KIO3+3H2O中,被氧化和被还原的碘原子物质的量之比为1:5
5KI+KIO3+3H2O中,被氧化和被还原的碘原子物质的量之比为1:5
D. 2FeS+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+2S↓+6H2O中,发生氧化反应和发生还原反应的硫原子物质的量之比为2:3
Fe2(SO4)3+3SO2↑+2S↓+6H2O中,发生氧化反应和发生还原反应的硫原子物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
①加热盛有二氧化锰、浓盐酸的烧瓶,瓶内充满黄绿色气体。
②氯气的密度比空气大,常用向上排空气法收集氯气。
③闻氯气气味时,用手轻轻在集气瓶口扇动,使极少量氯气飘进鼻孔。
④在充满氯气的集气瓶内加水,盖严后振荡,瓶内气体颜色变浅,液体变为黄绿色。
⑤氯气易液化,在低温和加压的条件下可以转变为液态(液氯)和固态。
⑥氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里迅速制备少量氯气可利用如下反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应不需加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)该反应中,氧化剂是________,还原剂是________。
(2)当参加反应的氧化剂的物质的量是1mol时,被氧化的还原剂的物质的量是________,产生的氯气在标准状况下的体积为________,电子转移数目为________。
(3)氯化氢在该反应过程中表现出的化学性质有________。
A 酸性B 还原性C 氧化性D 挥发性
查看答案和解析>>
科目:高中化学 来源: 题型:
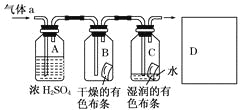
【题目】某同学应用如图所示的方法研究物质的性质,其中气体a的主要成分是氯气,杂质是空气和水蒸气.
回答下列问题:
(1)该项研究(实验)的主要目的是__________________________________________.
(2)浓硫酸的作用是____________________________________________,与研究目的的直接相关的实验现象是________________________________________.
(3)从物质性质的方面来看,这样的实验设计存在着事故隐患,事故表现是___________,请在图中D框中以图的形式表明克服事故隐患的措施___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸![]() 是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
物质 | 性质 |
|
|
实验Ⅰ:根据图提供的仪器和试剂,设计实验证明草酸的受热分解产物中含有![]() 和
和![]() 部分夹持仪器和加热装置省略
部分夹持仪器和加热装置省略![]()
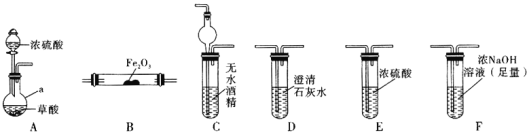
(1)仪器a的名称是_____________。
(2)各装置的正确连接顺序为![]() 装置可重复使用
装置可重复使用![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() 尾气处理。________________
尾气处理。________________
(3)用图中装置C的作用是____________________________。
(4)连接好装置进行的实验时,要先加热________![]() 填“A”“B”“C”“D”“E”或“F”
填“A”“B”“C”“D”“E”或“F”![]() 装置,能证明分解产物中有CO的实验依据是___________________。
装置,能证明分解产物中有CO的实验依据是___________________。
(5)某同学查阅资料发现,用氯化钯![]() 磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯
磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯![]() 固体,反应的化学方程式是___________________________。
固体,反应的化学方程式是___________________________。
实验 Ⅱ:草酸与甲醇在浓硫酸存在下酯化生成草酸二甲酯。反应为![]()
![]()
![]() 。在装有搅拌器、分水器的反应瓶中,加入草酸
。在装有搅拌器、分水器的反应瓶中,加入草酸![]() ,无水甲醇
,无水甲醇![]() ,苯
,苯![]() ,浓硫酸
,浓硫酸![]() ,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
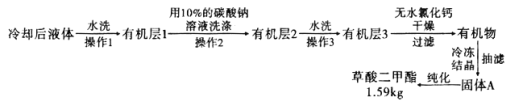
(6)![]() 提纯过程中用
提纯过程中用![]() 的碳酸钠溶液洗涤的作用是__________________________。
的碳酸钠溶液洗涤的作用是__________________________。
![]() 流程中纯化的方法为________________。
流程中纯化的方法为________________。
![]() 产率为____________
产率为____________![]() 精确到
精确到![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
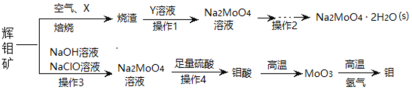
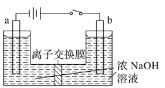
【题目】钼及其化合物正越来越多的受到人们的关注 ,其中钼酸钠(Na2MoO4)可溶于水,是一种重要的金属缓蚀剂;钼酸钙(CaMoO4)微溶于水,常用作钼合金添加剂;钼酸属于弱酸,微溶于水,常用于制取高纯同多酸盐。工业上利用辉钼矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如图所示。
回答下列问题:
(1)辉钼矿在空气中焙烧时,加入X是为了减少空气污染,焙烧后Mo元素以CaMoO4存在,则X是________;焙烧时发生反应的化学方程式为__________。
(2)已知25℃时,钼酸钙的Ksp=1.6×10-5,则钼酸钙在该温度下的溶解度为_______g/100g水,但钼酸钙实际溶解度比计算值大许多,其原因是_______,操作2中得到的钼酸钠晶体中常混有Y,进一步提纯钼酸钠晶体的方法为__________。
(3)辉钼矿中MoS2含量测定:取辉钼矿0.2500g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体0.1210g(Mr=242g/mol),辉钼矿中MoS2的质量分数不低于______%。
(4)操作3发生反应的离子方程式为_________________。
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如下图所示。b电极的材料为______(填“镍”或“钼”),电极反应为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电化学“大气固碳”电池工作原理如图所示。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法正确的是
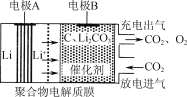
A.该电池放电时的正极反应为2Li-2e-+CO32-=Li2CO3
B.该电池既可选用含水电解液,也可选无水电解液
C.充电时阳极发生的反应为C+2Li2CO3-4e-=3CO2+4Li+
D.该电池每放、充4 mol电子一次,理论上能固定1 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.加入催化剂有利于合成氨的反应
B.由 H2(g)、I2(g)和 HI(g)组成的平衡体系加压后颜色变深
C.500 ℃时比室温更有利于合成氨的反应
D.光照新制的氯水时,溶液的 pH 逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com