
 ;
;

 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| A、H2(g)的消耗速率与HI(g)的生成速率之比为2:1 |
| B、正、逆反应速率的比值是恒定的 |
| C、当HI的分子数与I2分子数之比为2:1时,说明反应达到了平衡状态 |
| D、达到平衡时,正、逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
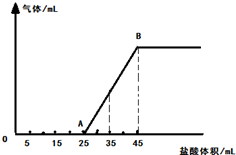 将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:
将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
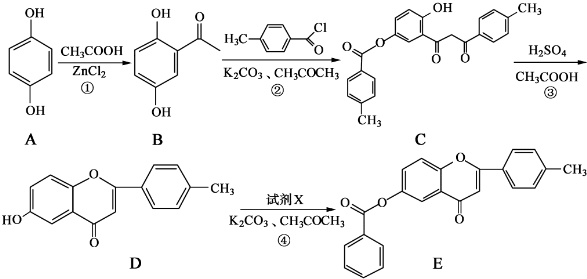

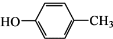 和CH3COOH为原料制备
和CH3COOH为原料制备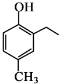 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌是负极,氧化银是正极 |
| B、锌发生还原方应,氧化银发生氧化反应 |
| C、溶液中OH-向正极移动,K+、H+向负极移动 |
| D、在电池放电过程中,电解质溶液的酸碱性基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
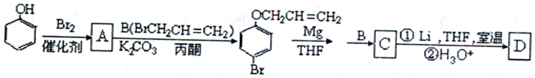
| Mg |
| THF |
| BrR2 |
| Li,THF室温 |
| H3O+ |
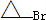 是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有
是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有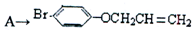 的有机反应类型
的有机反应类型| NaOH水溶液 |
| △① |
| HBr |
| ② |
| Cu,O2,△ |
| ③ |
| 新制Cu(OH)2 |
| △④ |
| 酸化 |
| ⑤ |
| -HBr |
| ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com