
下列有关说法正确的是
| A.常温下,0.1 mol·L-1 CH3COOH溶液的pH=1 |
| B.铅蓄电池在放电过程中,负极质量增加,正极pH减少 |
| C.反应CO2(g)+C(s)=2CO(g)在低温下不能自发进行,则其△H>0 |
| D.常温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小 |
科目:高中化学 来源: 题型:单选题
常温下,0.1mol·L-1CH3COONa溶液中,微粒浓度间关系正确的是
| A.c(Na+)=c(CH3COO-) >c(OH-)=c(H+) |
| B.c(OH-)=c(H+)+ c(CH3COOH) |
| C.c(Na+) + c(H+)= c(CH3COO-) +c(OH-) |
| D.c(CH3COOH) + c(CH3COO-) = c(Na+)+ c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,将VL0.10mol·L-1盐酸和VL0.06mol·L-1Ba(OH)2溶液混合后,该混合液的pH为(设混合后总体积为2VL)
| A.1.7 | B.12.3 | C.12 | D.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如下图,下列判断错误的是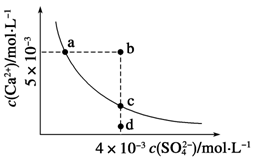
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
C.b点将有沉淀生成,平衡后溶液中c(SO )一定等于3×10-3 mol·L-1 )一定等于3×10-3 mol·L-1 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,对于0.1 mol.L-1pH= 10的Na2CO3溶液,下列说法正确的是
| A.通入CO2,溶液pH减小 |
B.加入NaOH固体,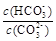 增大 增大 |
| C.由水电离的c(OH-) = 1×10-10 mol.L-1 |
| D.溶液中:c(CO32-)>c(OH-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是
| A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B.合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 |
| C.常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 |
| D.NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③ (NH4)2Fe(SO4)2三种溶液中水的电离程度:③>②>① |
B.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)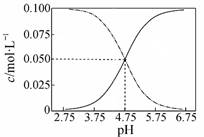 |
| C.向Ca(OH)2溶液中加入过量的NaHCO3溶液: Ca2++2HCO3-+2OH-→ CO32-+CaCO3↓+2H2O |
| D.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系: Kw ·K = Ka |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是 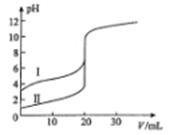
| A.II表示的是滴定醋酸的曲线 |
| B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL |
| C.V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-) |
| D.V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。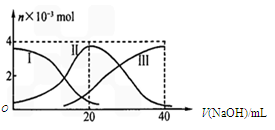
根据图示判断,下列说法正确的是
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合,其溶液中水的电离程度比纯水的大
C.向Na2A溶液加入水的过程中,pH可能增大也可能减小
D.NaHA溶液中:c(OH-)+c(A2-) = c(H+)+c(H2A)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com