
下列说法正确的是
| A.常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③ (NH4)2Fe(SO4)2三种溶液中水的电离程度:③>②>① |
B.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)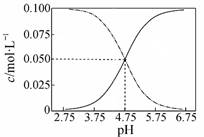 |
| C.向Ca(OH)2溶液中加入过量的NaHCO3溶液: Ca2++2HCO3-+2OH-→ CO32-+CaCO3↓+2H2O |
| D.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系: Kw ·K = Ka |
D
解析试题分析:A、常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4 ③ (NH4)2Fe(SO4)2三种溶液中水的电离程度:①>③>②,错误;B、由题给图像可知,常温下pH=4.5的醋酸和醋酸钠混合溶液中c(CH3COOH)>c(CH3COO-),错误;C、向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-→ CO32-+CaCO3↓+2H2O,正确;D、25°C时,HCN溶液的电离平衡常数Ka=[H+][CN—]/[HCN],NaCN溶液的水解平衡常数K=[OH—][HCN]/[CN—],则Ka ·K = Kw,错误。
考点:考查溶液中的离子平衡,涉及水的电离、弱电解质的电离、盐类水解、离子方程式正误判断。


科目:高中化学 来源: 题型:单选题
常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是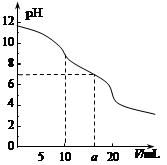
| A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-) |
| B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-) |
| C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3)[来源:学*科*网] |
| D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在Na2S溶液中下列关系不正确的是( )
| A.c(Na+)=2c(HS-)+c(S2-)+c(H2S) |
| B.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C.c(Na+)> c(S2-)>c(OH-)>c(HS-) |
| D.c(OH-)=c(HS-)+c(H+)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是
| A.常温下,0.1 mol·L-1 CH3COOH溶液的pH=1 |
| B.铅蓄电池在放电过程中,负极质量增加,正极pH减少 |
| C.反应CO2(g)+C(s)=2CO(g)在低温下不能自发进行,则其△H>0 |
| D.常温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小 |
| B.反应Hg(l)+H2SO4(aq)===HgSO4(aq)+H2(g)在常温下不能自发进行,则ΔH<0 |
| C.工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 |
| D.在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,下列溶液的离子浓度关系式正确的是
| A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1 |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合: c(Na+)+ c(H+)= c(OH-)+c( HC2O4-) |
| D.pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中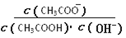 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有浓度均为0.1mol·L-1三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
T℃时,CaCO3和CaF2的Ksp分别为1.0 ×10-10。和4.0 ×10-12。下列说法正确的是
| A.T℃时,两饱和溶液中c(Ca2+ ):CaCO3>CaF2 |
| B.T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C.T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D.T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com