
在Na2S溶液中下列关系不正确的是( )
| A.c(Na+)=2c(HS-)+c(S2-)+c(H2S) |
| B.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C.c(Na+)> c(S2-)>c(OH-)>c(HS-) |
| D.c(OH-)=c(HS-)+c(H+)+2c(H2S) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
25℃时,水中存在电离平衡:

 。下列叙述正确的是
。下列叙述正确的是
A.将水加热, 增大, 增大, 不变 不变 |
B.向水中加入少量NaHSO4固体,c(H+)增大, 不变 不变 |
C.向水中加入少量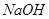 固体,平衡逆向移动, 固体,平衡逆向移动, 降低 降低 |
D.向水中加入少量 固体,平衡正向移动, 固体,平衡正向移动, 增大 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
| C.常温下,向10mL PH=3的醋酸溶液中加水稀释后,溶液中C(CH3COO--)/C(CH3COOH) C(OH--)的值减小 |
| D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH)/c(NH3·H2O)的值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,将VL0.10mol·L-1盐酸和VL0.06mol·L-1Ba(OH)2溶液混合后,该混合液的pH为(设混合后总体积为2VL)
| A.1.7 | B.12.3 | C.12 | D.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是:
A相同温度时,1mol/L氨水与05mol/L氨水中,c(OH-)之比是2:1
B.1mol/L氯化铵 溶液中c(NH4+)=c(Cl-)
C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中
D.硫化钠溶液中,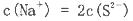
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如下图,下列判断错误的是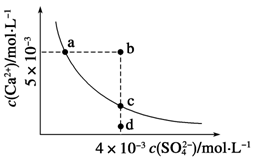
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
C.b点将有沉淀生成,平衡后溶液中c(SO )一定等于3×10-3 mol·L-1 )一定等于3×10-3 mol·L-1 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,对于0.1 mol.L-1pH= 10的Na2CO3溶液,下列说法正确的是
| A.通入CO2,溶液pH减小 |
B.加入NaOH固体,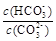 增大 增大 |
| C.由水电离的c(OH-) = 1×10-10 mol.L-1 |
| D.溶液中:c(CO32-)>c(OH-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③ (NH4)2Fe(SO4)2三种溶液中水的电离程度:③>②>① |
B.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)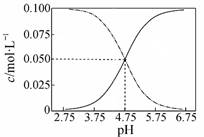 |
| C.向Ca(OH)2溶液中加入过量的NaHCO3溶液: Ca2++2HCO3-+2OH-→ CO32-+CaCO3↓+2H2O |
| D.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系: Kw ·K = Ka |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com