
【题目】下图为元素周期表的一部分:
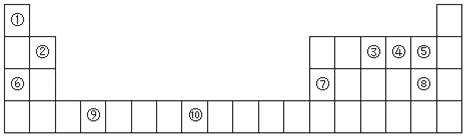
I.(1)元素③的基态原子轨道表示式为_________________。
(2)元素③④⑤的第一电离能由大到小的顺序为___________(填元素符号)。
(3)以下组合的原子间反应最容易形成离子键的是_____(选填A、B、C、D,下同)。
A.②和⑤ B.和⑤ C.⑤和⑥ D.⑥和⑧
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式_________________________________。
II.(1)如图是部分元素原子的第一电离能I1随原子序数变化关系(其中12号至17号元素的有关数据缺失)。
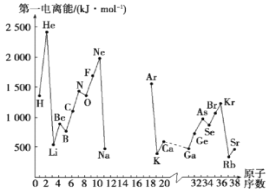
①根据同图示变化规律,可推测S的第一电离能的大小(最小)范围为___< S <___ (填元素符号)
②图中第一电离能最小的元素在周期表中的位置 ____________________
(2)用In表示元素的第n电离能,则图中的a、b、c分别代表(__________)
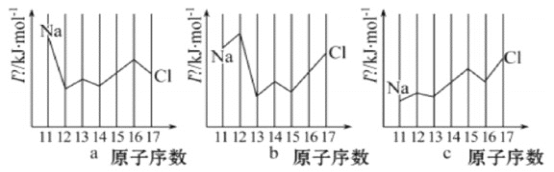
A.a为I1、b为I2、c为I3 B.a为I3、b为I2、c为I1
C.a为I2、b为I3、c为I1 D.a为I1、b为I3、c为I2
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________________________________________
【答案】![]() F>N>O C 2OH﹣+BeO=BeO22﹣+H2O Si P 第五周期IA族 C Cu原子失去一个电子后,核外电子排布为
F>N>O C 2OH﹣+BeO=BeO22﹣+H2O Si P 第五周期IA族 C Cu原子失去一个电子后,核外电子排布为![]() ,而锌为[Ar]3d104s1,根据洪特则,铜达到了较稳定状态,所以Cu的第二电离能相对较大
,而锌为[Ar]3d104s1,根据洪特则,铜达到了较稳定状态,所以Cu的第二电离能相对较大
【解析】
根据元素在周期表中的位置可知,①至⑩号元素分别为H,Be,N,O,F,Na,Al,Cl,Ti,Fe。
Ⅰ(1)由图可知,③为N元素,基态原子电子排布式为:1s22s22p3,则基态原子轨道表示式为:![]() ;
;
(2)同一周期第一电离能随原子序数增大呈现增大的趋势,但同一周期第ⅡA族元素比第ⅢA族元素的第一电离能大,第ⅤA族比第ⅥA族第一电离能大,所以N,O,F三种元素的第一电离能从大到小次序为F>N>O;
(3)由周期表中的位置可知,①为H,②Be,⑤为F,⑥为Na,⑧为Cl,五种元素中最活泼的金属钠和最活泼的非金属氟之间最容易形成离子键,C项正确;答案选C;
(4)由于Be与Al的性质相似,所以参照Al2O3与NaOH溶液的反应,BeO与NaOH溶液反应的离子方程式为:![]() ;
;
Ⅱ(1)①同一周期第一电离能随原子序数增大呈现增大的趋势,但同一周期第ⅡA族元素比第ⅢA族元素的第一电离能大,第ⅤA族比第ⅥA族第一电离能大;所以S的第一电离能大于Si,小于P;
②金属性越强,越容易失去电子,第一电离能越小,图中第一电离能最小的元素是铷,在第五周期ⅠA族;
(2) a中Na元素的电离能远大于Mg的电离能,则a应表示的是I2;b中Na元素的电离能小于Mg的电离能,Mg的电离能远大于Al的电离能,则b应表示的是I3;c中Al元素的电离能小于Mg的电离能,S元素的电离能小于P的电离能,并且从N到Cl,电离能呈现较明显的增加的趋势,则c应表示的是I1,C项正确;
答案选C;
(3) Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,根据洪特则,铜达到了较稳定状态,所以Cu的第二电离能相对较大;


科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、千燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
A.K一定存在B.100mL溶液中含0.01 mol CO32-
C.Cl-可能存在D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的![]() 的原子和价电子排布为4s24p5的原子
的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
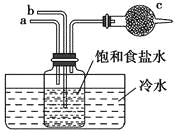
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铝粉与某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等份。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为3.92 L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为
A. 2.80 LB. 3.92 LC. 5.60 LD. 7.84 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
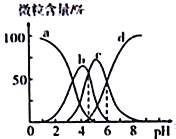
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )

A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
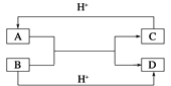
(1)如果A,B,C,D均是10电子的粒子,请写出A,D的电子式:A_______;D_______。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式为__________。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的方法正确的是
A.FeCl3溶液(CuCl2),加入Fe粉,过滤
B.CO2(SO2),通入饱和Na2CO3溶液中
C.NO(NO2),通入水中
D.Na2CO3溶液(Na2SO4),加入过量Ba(OH)2溶液,过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com