
| A、60gSiO2中含Si-O键的个数为2NA |
| B、晶体中微粒堆积不服从紧密堆积原理的原因是共价键具有饱和性和方向性 |
| C、SiO2晶体的熔沸点较干冰高是由于晶体类型不同 |
| D、与硅原子最近的四个氧原子构成一个正四面体 |


科目:高中化学 来源: 题型:
| A、SiO2 CsCl I2 Br2 |
| B、SiO2 CsCl Br2 I2 |
| C、CsCl SiO2 I2 Br2 |
| D、Br2 I2 CsCl SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和溴苯均为芳香烃 |
| B、酚醛树脂和聚乙烯均为体型高分子材料 |
| C、葡萄糖和麦芽糖均为还原性糖 |
| D、油脂和淀粉均为天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 配制一定物质的量浓度的稀硫酸 |
B、 制取少量的Fe(OH)3胶体 |
C、 用H2SO4标准溶液滴定NaOH溶液 |
D、 称量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为得到较大的晶体颗粒,结晶时通常采用浓度较低,溶剂蒸发速度较慢或溶液冷却较慢的条件 |
| B、纸层析中,滤纸作为固定相,展开剂作为流动相 |
| C、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 |
| D、用硝酸银溶液可以鉴别NaCl溶液和NaNO2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| D |
| D |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
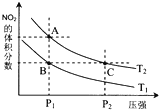 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是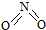 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的平均键能为466kJ?mol-1,N2O4中氮氧键的平均键能为438.5kJ?mol-1.
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的平均键能为466kJ?mol-1,N2O4中氮氧键的平均键能为438.5kJ?mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com