
����Ŀ��H2S������Դ������;��֮һ�ǻ����������õ�������Ӧԭ��Ϊ��2H2S��g��+O2��g���TS2��s��+2H2O��l����H=��632kJmol��1����ͼΪ����ĤH2Sȼ�ϵ�ص�ʾ��ͼ������˵����ȷ���ǣ� ��

A���缫aΪ��ص�����
B���缫b�Ϸ����ĵ缫��ӦΪ��O2+2H2O+4e��=4 OH��
C����·��ÿ����4mol���ӣ�����ڲ��ͷ�632kJ����
D��ÿ17gH2S���뷴Ӧ����1mol H+������Ĥ����������
���𰸡�D
��������
�����������2H2S��g��+O2��g���TS2��s��+2H2O��l������֪H2S����������Ӧ����S2������aΪ��ص���������A��ȷ��������b���õ��ӷ�����ԭ��Ӧ���缫��ӦΪ��O2+4H++4e��=2H2O����B����ԭ��ؽ���ѧ����Ҫת��Ϊ���ܣ������ڲ��������ͷ����ܣ���C����17gH2S�����ʵ�����0.5mol��ÿ17gH2S���뷴Ӧ����1mol H+������Ĥ��������������D��ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L���ܱ������У�X��Y��Z����Ϊ���壩�������ʵ�����ʱ��ı仯������ͼ��ʾ��
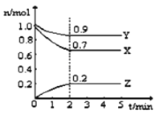
��1����ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ����ʼ��2��������Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)= ��
��3��2min��Ӧ��ƽ�������ڻ�������ƽ����Է�����������ʼʱ ��������С��������������ܶȱ���ʼʱ ��������С�䣩��
��4�����д�ʩ�ܼӿ췴Ӧ���ʵ��� ��
A������ʱ����X B����ʱ�����Z C�������¶� D��ѡ���Ч�Ĵ���
��5������˵����ȷ���� ��
A�������¶ȿ��Ըı仯ѧ��Ӧ��ƽ��״̬
B����֪����Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ�������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C���ﵽ��ѧ��Ӧ��ƽ��״̬��ʱ�䳤����
D����ѧ��Ӧ��ƽ��״̬�Dz����ܸı��
E������Y��Ũ�ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����ȷ����(����)
A. ��ɫʳƷ�Dz����κλ�ѧ���ʵ�ʳƷ
B. �ӵ�ʳ�������ӵ�������һ���ǵ����
C. �����Ȼ�����Һ������������������ö����ЧӦ
D. ��ʪ�����ɫ�������Լ����Ȼ����������Ƿ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ӣ�������Һ�д���������ǣ� ��
A��H+��Na+��CO32��
B��Cl����Ba2+��SO42��
C��Fe3+��OH����SO42��
D��H+��Ag+��NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʲ����ɵ���ֱ�ӷ�Ӧ�Ƶõ��ǣ�������
A. Na2O2 B. Fe3O4 C. CuCl2 D. FeCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ�����ȷ����
ѡ�� | �� | �� | �� | ���������� | �ǵ���� |
A | NaOH | H2SO4 | K2SO4 | Na2O | CO2 |
B | Na2CO3 | HC1 | NaCI | Na2O | ���� |
C | KOH | HNO3 | CaCO3 | CaO | Cu |
D | NaOH | HC1 | HF | K2O | SO2 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�ã�������������ȷ���ǣ� ��

A��a��b������ʱ����Ƭ�ϻ��н���ͭ����
B��a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪ��Cu2++2e��=Cu
C������a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ����ɫ��� dz��ɫ
D��a��b�ֱ�����ֱ����Դ������������ѹ�㹻��ʱ��Cu2+��ͭ�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ�����ӷ���ʽ���� �� ��
A. CaCO3��2H+ �� Ca2+��CO2����H2O B. 2Fe2+��Cl2 �� 2Fe3+��2Cl
C. HCO3����+ �� CO2��H2O D. 2Na��2H2O �� 2NaOH ��H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��ICl�ķ�Ӧ�֢١����������У���������������ͼ��ʾ�������й�˵��������ǣ� ��

A����Ӧ�١���Ӧ�ھ�Ϊ���ȷ�Ӧ
B����Ӧ�١���Ӧ�ھ�Ϊ������ԭ��Ӧ
C����Ӧ�ٱȷ�Ӧ�ڵ�������������Ӧ����Ӧ�Ļ����
D����Ӧ�١���Ӧ�ڵ��ʱ�֮��Ϊ��H=��218kJmol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com