
| 10-2xV1×10-3 |
| 10-1 |
| 2cV2 |
| V1 |
| 135c2V2 |
| V1 |
| 135c2V2 |
| V1 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
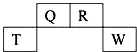 如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )
如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )| A、气态氢化物稳定性:R>Q |
| B、Q与W可形成直线型分子QW2 |
| C、同主族气态氢化物中R的氢化物最稳定,因其分子间存在氢键 |
| D、原子半径:T>W,简单离子半径:T<W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol?L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、难溶电解质作比较时,Ksp小的,溶解度一定小 |
| B、Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀平衡会发生移动 |
| C、所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去 |
| D、温度一定,当溶液中Ag+ 和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 |
| B、加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体.溶液中一定含有大量的NH4?+ |
| C、加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO3 2- |
| D、先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定大于92.0 kJ |
| B、无法确定 |
| C、一定小于92.0 kJ/mol |
| D、一定小于92.0 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向500mL 1 mol/LNa2CO3溶液中,滴加600mL 1 mol/LHCl 得到标况下CO2体积为2.24L |
| B、电解精炼铜时,若阴极得到2摩尔电子,则阳极质量减少64克 |
| C、将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol?L-1 |
| D、可用pH试纸测得氯水的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25°C时,pH=10的CH3COONa溶液与pH=10的氨水中,c(OH-)之此为1:1 |
| B、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) |
| C、浓度相同的①CH3COONa②NaNO3③Na2CO3④NaOH四种溶液,pH的大小顺序是:④>③>②>① |
| D、只含NH4+、Cl-、H+、OH-四种离子的酸性溶液中,一定存在:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、塑料是以石油、天然气为原料,以二烯烃和烯烃为单体聚合成的高分子 |
| B、光导纤维是一种能高质量传导光的玻璃纤维,属于具有特殊性能的合成纤维 |
| C、塑料制品在土壤中容易被微生物分解,所以废弃塑料制品不会对环境造成严重的污染 |
| D、工程塑料具有某些优异的性能,可作为工程材料代替某些金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com