
【题目】某物质的结构式如下:
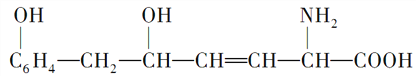 ,
,
下列叙述中不正确的是( )
A. 1mol该物质最多可与1molH2加成
B. 1mol该物质最多可与2mol NaOH完全反应
C. 该物质可与醇发生酯化反应,也可与酸发生酯化反应
D. 该物质既能与碱反应,又能与盐酸反应,也能与氯化氢反应
科目:高中化学 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:

已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 该反应达到平衡后,保持容器休积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C. 830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻v正<v逆
D. 830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放显减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1L恒容中,硫可以发生如下较化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
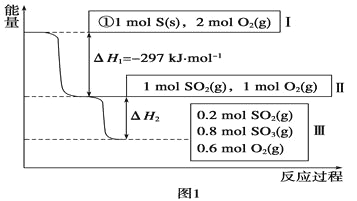
①写出能表示硫的燃烧热的热化学方程式:_________。,
②ΔH2=_________kJ·mol-1。
③在相同条件下,充入1molSO3和0.5mol的O2,则达到平衡时SO3的转化率为_______;此时该反应______(填“放出“或“吸收”)_______kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下40%~50%。
①CO2可转化成有机物实现碳循环。在休积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3min到9min,v(H2)=_______mol/(L·min)
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3min到9min,v(H2)=_______mol/(L·min)
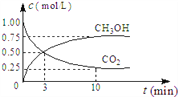
②为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有_______ (填编号)。
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO2和H2合成。参考合成反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数。下列说法正确的是______________。
CH3OH(g)的平衡常数。下列说法正确的是______________。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
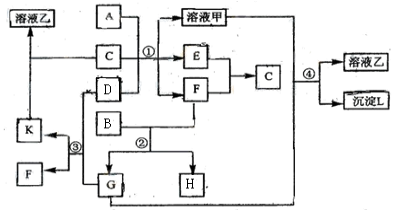
(1)A、B、C、D代表的物质分别为 、 、 、 (填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是 ;
![]() (3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
![]() (4)反应③产物中K的化学式为 ;
(4)反应③产物中K的化学式为 ;
![]() (5)反应④的离子方程式为 。
(5)反应④的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题: 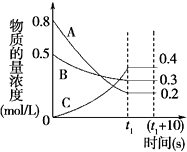
(1)该反应的化学方程式为 .
(2)0~t1 s内A气体的反应速率为 .
(3)反应后与反应前的压强之比为 .
(4)(t1+10)s时,A气体的体积分数为 , 此时v(A)正v(B)逆(填“>”、“<”或“=”).
(5)关于该反应的说法正确的是 .
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 化学反应必然伴随发生能量变化
B. 石灰石烧制石灰是吸热反应
C. 反应的活化能越大,该化学反应前后的能量变化就越大
D. 将AgN03溶液滴加到KC1溶液中,反应的活化能几乎为零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com