


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.任何浓度溶液的酸碱性都可用pH试纸测定 |
| B.某温度下,pH=6.2的纯水显酸性 |
| C.25℃时,pH=1的醋酸溶液中c(H+)是pH=2的盐酸溶液中c(H+)的10倍 |
| D.25℃时,pH=12的NaOH溶液中的n(OH-)=10-2mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
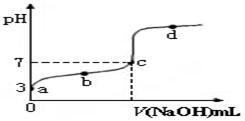
| A.a点时,CH3COOH的电离度是1% |
| B.b点时,溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中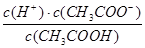 均等于K 均等于K |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
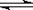 H+ + OH-。下列叙述中,正确的是
H+ + OH-。下列叙述中,正确的是 | A.升高温度,KW增大,pH不变 |
| B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 |
| C.向水中加入少量硫酸,c(H+)增大,KW不变 |
| D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
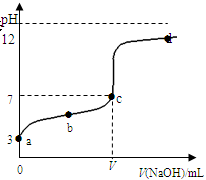
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该溶液的溶质是碱 | B.该溶液显碱性 |
| C.该溶液的溶质是酸 | D.该溶液的溶质是盐 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
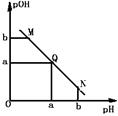
| A.M点所示溶液中c(Na+)﹥c(CH3COO-)﹥c(OH-)﹥c(H+) |
| B.N点所示溶液中c(CH3COO-)﹥c(Na+) |
| C.M点和N点所示溶液中水的电离程度相同 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.01 mol·L-1 | B.0.017 mol·L-1 | C.0.05 mol·L-1 | D.0.50 mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com