
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
(1)联氨分子的电子式为______________,
(2)联氨为二元弱碱,在水中的电离方式与氨相似。写出在水中联氨第一步电离反应的方程式______________________________________________________。
(3)已知12.8 g的液态高能燃料联氨在氧气中燃烧,生成气态N2和液态水,放出248.8kJ的热量。写出表示液态联氨燃烧热的热化学方程式___________________。
(4)已知①2O2(g)+N2(g)=N2O4(l) ;ΔH1
②N2(g)+2H2(g)=N2H4(l) ;ΔH2
③O2(g)+2H2(g)=2H2O(g) ; ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ;ΔH4
上述反应热效应之间的关系式为ΔH4=_________________,联氨和N2O4可作为火箭推进剂的主要原因为____________________________________________ (至少答2点)。
【答案】![]() N2H4+H2O
N2H4+H2O![]() N2H+OH- N2H4 (l) + O2(g) = N2(g) + 2H2O(l) ;△H= —622.0 kJ/mol 2ΔH3—2ΔH2—ΔH1 反应放热量大、产生大量气体、产物无污染
N2H+OH- N2H4 (l) + O2(g) = N2(g) + 2H2O(l) ;△H= —622.0 kJ/mol 2ΔH3—2ΔH2—ΔH1 反应放热量大、产生大量气体、产物无污染
【解析】
(1)联氨分子式为N2H4,氮氢原子间形成单键,氮氮原子间形成单键,电子式为![]() ;综上所述,本题答案是:
;综上所述,本题答案是:![]() 。
。
(2)一水合氨的电离:NH3H2O![]() NH4++OH- , 联氨为二元弱碱,在水中的电离方式与氨相似,第一步电离反应的方程式:N2H4+H2O
NH4++OH- , 联氨为二元弱碱,在水中的电离方式与氨相似,第一步电离反应的方程式:N2H4+H2O![]() N2H+OH-;综上所述,本题答案是:N2H4+H2O
N2H+OH-;综上所述,本题答案是:N2H4+H2O![]() N2H+OH-。
N2H+OH-。
(3)反应方程式为:N2H4+O2═N2+2H2O,0.4mol液态肼放出248.8kJ的热量,则1mol液态肼放出的热量为248.8/0.4=622kJ,所以反应的热化学方程式为:N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-622kJ/mol;综上所述,本题答案是: N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-622kJmol-1。
(4)①2O2(g)+N2(g)═N2O4(l)△H1,②N2(g)+2H2(g)═N2H4(l)△H2,③O2(g)+2H2(g)═2H2O(g)△H3,依据热化学方程式和盖斯定律计算③×2-②×2-①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=2△H3-2△H2-△H1;根据反应④可知,联氨和N2O4反应放出大量热且产生大量气体,且对环境无危害,因此可作为火箭推进剂;
综上所述,本题答案是:2ΔH3—2ΔH2—ΔH1 ;反应放热量大、产生大量气体、产物无污染。


科目:高中化学 来源: 题型:
【题目】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)烧杯间填满碎泡沫塑料的作用是___________________________
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_______(填“能”或“不能”), 其原因是____________________________。
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是___________________________。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量________________(填“相等”“不相等”),若实验操作均正确,则所求中和热_________(填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油和淀粉或纤维素为原料均可制得乙酸乙酯,转化关系如下图:
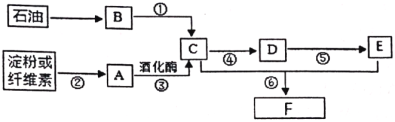
其中气体B在标况下的密度为:1.25 g/L。请回答:
(1)B中官能团的名称是________。
(2)A的分子式是________。
(3)反应④的化学方程式为________。
(4)下列说法正确的是________。
A.反应②⑤⑥属于取代反应
B.物质F的结构简式为CH3CH2OOCCH3
C.B和E可在一定条件下直接合成F,该方法符合绿色化学理念
D.可用新制氢氧化铜鉴别C、D、E三种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl)试剂_______,离子方程式:____________________________________。
(2)CO2(HCl)试剂___________,离子方程式:__________________________________。
(3)O2(CO2)试剂__________,离子方程式:____________________________________。
(4)SO42-(CO32-)试剂_______,离子方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是
A. X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B. Y、Q形成的化合物是强电解质
C. 电解X、Q元素组成的化合物的饱和溶液常被用于实验室制备E单质
D. W、X、Q三种元素都能形成多种氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应发生在同种元素之间的是( )
A. Zn+2HCl![]() ZnCl2+H2↑
ZnCl2+H2↑
B. 2H2S+SO2![]() 3S↓+2H2O
3S↓+2H2O
C. H2+CuO![]() Cu+H2O
Cu+H2O
D. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请填写下表:
物质 | 摩尔质量 | 物质的量 | 质量 | 分子或离子数目 |
SO2 | ________ | 2 mol | ________ | ________ |
SO42- | ________ | ________ | ________ | 6.02×1022 |
O2 | ________ | ________ | 8.0 g | ________ |
(2)O2和O3是氧元素的两种单质。根据分子式回答。等质量的O2和O3所含分子数之比为____,原子个数比为____。
(3)摩尔质量是指单位物质的量的物质所含有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为____。
②1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,且Ca(HCO3)2易溶于水。现有Ca(OH)2溶液,向其溶液中逐渐通入CO2。则下列四个图中,能比较准确地反映出溶液的导电能力和通入CO2气体量的关系的是(x轴表示CO2通入的量,y轴表示导电能力)
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油和脂肪的说法正确的是( )
A.二者互为同分异构体B.二者仅状态不同,化学性质相同
C.前者熔点高,后者熔点低D.在一定条件下前者可转化为后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com