
【题目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1molL-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
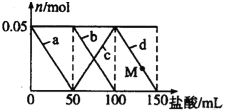
A. a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3
B. b和c曲线表示的离子反应是相同的
C. M点时Al(OH)3的质量小于3.9g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为2:1
【答案】D
【解析】试题分析:Na2CO3、NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-减少,第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d线表示HCO3-减少,此阶段Al(OH)3不参与反应。A.Na2CO3,NaAlO2的混合溶液中加入HCl溶液,先发生反应:AlO2-+H++H2O═Al(OH)3↓,A正确;B.第二阶段,AlO2-反应完毕,发生反应:CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,所以b和c曲线表示的离子反应是相同的,B正确;C.盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO32-反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)=0.05mol,m[Al(OH)3]=0.05mol×78g/mol=3.9g,C正确;D.第一、第二两段消耗的盐酸的体积都是50ml,所以消耗的氯化氢的物质的量相等,依据第一阶段、第二阶段发生反应AlO2-+H++H2O═Al(OH)3↓,CO32-+H+═HCO3-,可知CO32-与AlO2-的物质的量之比为1:1,但这两种物质都是强碱弱酸盐都能水解,水解程度不同导致无法判断溶液中CO32-与AlO2-的物质的量之比,D错误;答案选D。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。某校化学兴趣小组,利用工业烧渣为原料,设计如下制备硫酸亚铁的方案。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2 等)制备绿矾(FeSO4·7H2O)。工艺流程如下所示:
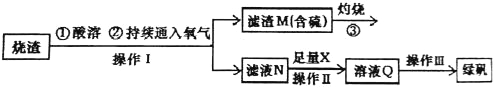
(1)烧渣在进行酸溶时用到了稀硫酸。他们在配制所需的稀硫酸时使用了自来水,有同学提出自来水中含有少量的Cl-,会影响到制出的FeSO4 的纯度。请你设计实验证明已配制的稀硫酸中混有Cl-。
_______________________。
(2)过程③灼烧时产生的气体通入下列溶液中,溶液不会褪色的是___________
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.红色的酚酞试液
(3)X 是 , 此时滤液N 中发生反应的离子方程式为 。检验溶液Q 中含有的金属阳离子的实验方法是 。
(4)操作III 的操作步骤为蒸发浓缩、 、过滤( 填操作名称)、 、干燥。
(5)硫酸亚铁可以用于治疗缺铁性贫血症,某严重贫血患者共需补充2.8g铁元素,服用的药品中相当于需要绿矾的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol某链烃最多能和2 mol氯化氢发生加成反应,生成氯代烷1 mol,该氯代烷能和6 mol氯气发生取代反应,生成只含碳元素和氯元素的氯代烃,该烃可能是( )
A.丙烯 B.丙炔 C.1-丁炔 D.1,3-丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修3—物质结构与性质】
A、B、W、D、L为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)W2-离子的结构示意图为__________,E元素在周期表中的位置为_________,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式____________________。
(2)经测定A2W2为二元弱酸,A2W2的电子式为____________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式___________________。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成,当消耗2molI-时,共转移3mol电子,该反应的离子方程式是________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式_____________,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_____________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A.1∶2 B.1∶4 C.3∶4 D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴氯水后混合液出现红色,那么由此得出的下列结论,错误的是( )
A.该晶体中一定含有SCN-
B.Fe3+的氧化性比氯气的氧化性强
C.Fe2+被Cl2氧化为Fe3+
D.Fe3+与SCN-能形成红色的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com