
【题目】硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。某校化学兴趣小组,利用工业烧渣为原料,设计如下制备硫酸亚铁的方案。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2 等)制备绿矾(FeSO4·7H2O)。工艺流程如下所示:
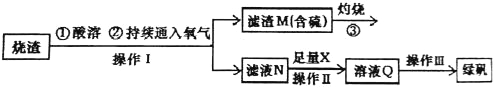
(1)烧渣在进行酸溶时用到了稀硫酸。他们在配制所需的稀硫酸时使用了自来水,有同学提出自来水中含有少量的Cl-,会影响到制出的FeSO4 的纯度。请你设计实验证明已配制的稀硫酸中混有Cl-。
_______________________。
(2)过程③灼烧时产生的气体通入下列溶液中,溶液不会褪色的是___________
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.红色的酚酞试液
(3)X 是 , 此时滤液N 中发生反应的离子方程式为 。检验溶液Q 中含有的金属阳离子的实验方法是 。
(4)操作III 的操作步骤为蒸发浓缩、 、过滤( 填操作名称)、 、干燥。
(5)硫酸亚铁可以用于治疗缺铁性贫血症,某严重贫血患者共需补充2.8g铁元素,服用的药品中相当于需要绿矾的质量为_________。
【答案】(1)取少量配制好的硫酸溶液,加入过量的硝酸钡溶液,充分振荡后过滤,向过滤所得的滤液中滴加硝酸酸化的硝酸银溶液,振荡,若生成白色沉淀 该溶液中含有氯离子。(2)B(3)铁粉;Fe+2Fe3+=3Fe2+;取待测液于试管中,先滴入几滴KSCN,无明显现象,滴入双氧水或氯水,溶液变血红色,则说明溶液中含有亚铁离子(4)冷却结晶;洗涤(5)13.9g
【解析】
试题分析:烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾,为了减少引入新杂质,所以用硫酸溶解并通入足量氧气,反应后过滤得到滤渣M和溶液N,滤渣M中含硫,灼烧后会产生二氧化硫,溶液N中主要溶质为硫酸铁,加入足量的铁粉反应生成硫酸亚铁,过滤除去多余的铁粉,得到硫酸亚铁溶液,将硫酸亚铁溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到绿矾。
(1)设计实验证明已配制的稀硫酸中混有Cl-,首先要排除硫酸根离子的干扰,故要先用硝酸钡除去硫酸根,然后用硝酸银检验氯离子,即取少量配制好的硫酸溶液,加入过量的硝酸钡溶液,充分振荡后过滤,向过滤所得的滤液中滴加硝酸酸化的硝酸银溶液,振荡,若生成白色沉淀 该溶液中含有氯离子。
(2)过程中灼烧时产生的气体为SO2,具有还原性和漂白性及酸性氧化物的通性,能使品红褪色,能与酸性KMnO4溶液发生氧化还原反应而使其褪色,能与碱反应使红色的酚酞试液褪色,不能使紫色石蕊溶液褪色,答案选B;
(3)根据流程分析可知,溶液N中主要溶质为硫酸铁,要制得绿矾要加铁粉,反应的离子方程式为 Fe+2Fe3+=3Fe2+,检验亚铁离子的方法是取待测液于试管中,滴入几滴KSCN,无明显现象,滴入双氧水或氯水,溶液变血红色,则说明溶液中含有亚铁离子;
(4)从硫酸亚铁溶液中得到绿矾,要将硫酸亚铁溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)2.8g铁元素的物质的量是0.05mol,服用的药品中相当于需要绿矾的质量为0.05mol×278g/mol=13.9g;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:①A—I均为芳香族化合物,A的分子式为C8H10O, E的分子式为C7H7Cl,I的分子式为C23H22O3
②A的苯环上只有一个取代基,B能发生银镜反应,D的相对分子质量比C大4,E的核磁共振氢谱有3组峰
③![]()
④![]()
芳香酯I的合成路线如下:

请回答下列问题:
(1)A→B的反应类型为 ,E的名称为 ;
(2)E→F与F→G的顺序不能颠倒,理由是 ;
(3)B与银氨溶液反应的化学方程式为 ;
(4)I的结构简式为 ;
(5)符合下列要求A的同分异构体还有 种(不包括A);
①与Na反应并产生H2 ②芳香族化合物
(6)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将_________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将_______________。
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)2N2O5(g) △H<0的影响.

(1)图象中T1和T2的关系是T1_________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是_________(填字母);
(3)若容器体积为1L,n=1mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数K=_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中应用广泛,用所学知识回答问题:
(1)联氨是一种可燃性液体,可用作火箭燃料。已知32.0g N2H4和H2O2反应生成氮气和水(气态),放出热量642kJ,该反应的热化学方程式是: 。
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(3)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取4.74 g KMnO4样品溶解酸化共配成100mL溶液,取出20mL于锥形瓶中,用0.100mol/L标准Na2S2O3溶液进行滴定,滴定至终点的现象是 。实验中,滴定至终点时消耗Na2S2O3溶液24.00mL,则该样品中KMnO4的纯度是 。(有关离子方程式为:8MnO4-+5S2O32-+14H+=8Mn2++10SO42-+7H2O)
(4)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是____ ,又变为棕黄色的原因是 。[
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 第三周期所含的元素中钠的第一电离能最小
B. 铝的第一电离能比镁的第一电离能大
C. 在所有元素中,氟的第一电离能最大
D. 钾的第一电离能比镁的第一电离能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对胶体知识认识正确的是
A.溶液是电中性的,胶体是带电的
B.向饱和氯化铁溶液中滴加过量氨水,可制取氢氧化铁胶体
C.葡萄糖注射液能产生丁达尔效应,属于胶体
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者没有
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1molL-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
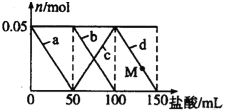
A. a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3
B. b和c曲线表示的离子反应是相同的
C. M点时Al(OH)3的质量小于3.9g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.有机物中都存在同分异构现象
B.只要含有的官能团种类相同就是同系物
C.14C和14Si是同位素
D.C2H5Cl没有同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.各组成元素质量分数相同的烃是同一种烃
B.结构相似,组成上相差一个或若干个CH2原子团的有机物是同系物
C.能使溴的四氯化碳溶液褪色的烃一定是烯烃
D.C3H6和C4H8不一定是同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com