
【题目】下列说法正确的是( )
A. 第三周期所含的元素中钠的第一电离能最小
B. 铝的第一电离能比镁的第一电离能大
C. 在所有元素中,氟的第一电离能最大
D. 钾的第一电离能比镁的第一电离能大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:H2A的A2-可表示S2-、SO42-、SO32-、SiO32-或CO32-。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
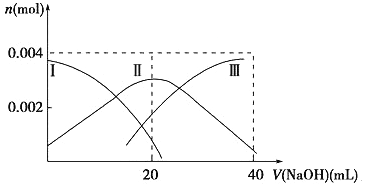
当V(NaOH)=20 mL时,溶液中离子浓度大小关系:____________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水____________(填“大”、“小”或“相等”)。
(2)若H2A为硫酸:t℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=____________。
Ⅱ.已知:在25 ℃时 H2O![]() H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH![]() H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh具体数值=________________,
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a,1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为___________, a与b的关系为______________。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列金属的熔沸点:
金属 | Na | Cu | Al | Fe |
熔点(℃) | 97.5 | 1083 | 660 | 1535 |
沸点/℃ | 883 | 2595 | 2200 | 3000 |
不能形成合金的两金属是( )
A.Cu与Na
B.Fe与Cu
C.Fe与Al
D.Al与Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
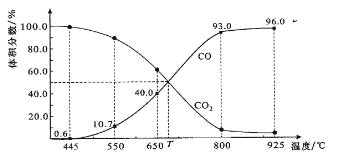
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。某校化学兴趣小组,利用工业烧渣为原料,设计如下制备硫酸亚铁的方案。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2 等)制备绿矾(FeSO4·7H2O)。工艺流程如下所示:
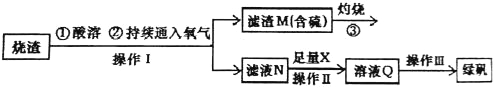
(1)烧渣在进行酸溶时用到了稀硫酸。他们在配制所需的稀硫酸时使用了自来水,有同学提出自来水中含有少量的Cl-,会影响到制出的FeSO4 的纯度。请你设计实验证明已配制的稀硫酸中混有Cl-。
_______________________。
(2)过程③灼烧时产生的气体通入下列溶液中,溶液不会褪色的是___________
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.红色的酚酞试液
(3)X 是 , 此时滤液N 中发生反应的离子方程式为 。检验溶液Q 中含有的金属阳离子的实验方法是 。
(4)操作III 的操作步骤为蒸发浓缩、 、过滤( 填操作名称)、 、干燥。
(5)硫酸亚铁可以用于治疗缺铁性贫血症,某严重贫血患者共需补充2.8g铁元素,服用的药品中相当于需要绿矾的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修3—物质结构与性质】
A、B、W、D、L为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)W2-离子的结构示意图为__________,E元素在周期表中的位置为_________,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式____________________。
(2)经测定A2W2为二元弱酸,A2W2的电子式为____________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式___________________。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成,当消耗2molI-时,共转移3mol电子,该反应的离子方程式是________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式_____________,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_____________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al
B.Al(OH)3
C.AlCl3
D.Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com