
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?______________;简要说明理由____________________________________。
(3)该同学无法断定SO2与Na2O2反应中是否有氧气生成,拟使用下列装置进行实验。

装置中B的作用是___________________________________________________,D的作用是______________________________________________________________。
(4)为确认反应产物,该同学设计了以下实验步骤,你认为应进行的操作按先后顺序排列应是(填序号)________________。
A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧
B.将C装置中反应后的固体物质溶于适量水配成溶液
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成
(1)2CO2+2Na2O2====2Na2CO3+O2
(2)合理 由于过氧化钠具有强氧化性,能将+4价的硫氧化为+6价的硫而生成硫酸钠
(3)干燥SO2气体,防止水蒸气进入C装置与Na2O2反应 防止空气中的水蒸气进入C装置与Na2O2反应生成氧气,同时吸收过量的SO2气体,便于氧气的检验和防止污染空气
(4)ABD
解析:(3)要判断SO2与Na2O2反应是否生成O2,必须将SO2中含有的能与Na2O2反应产生O2的H2O(g)事先除去,才能得到正确的结论。同时还要防止空气中的CO2和H2O(g)进入C中造成干扰。
(4)检验![]() 的存在,须防止
的存在,须防止![]() 的干扰,因而在加BaCl2前应先加盐酸将
的干扰,因而在加BaCl2前应先加盐酸将![]() 的干扰消除。若用HNO3与Ba(NO3)2检验,可将
的干扰消除。若用HNO3与Ba(NO3)2检验,可将![]() 转化为
转化为![]() ,这样易造成错误的判断。
,这样易造成错误的判断。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:

| ||
| ||

| n(NH4HCO3) |
| n(NaCl) |
| n(NH4HCO3) |
| n(NaCl) |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省、广雅高三四校联考理综化学试卷(解析版) 题型:填空题
煤制备CH4是一种有发展前景的新技术。
I. 煤炭气化并制备CH4包括以下反应:
C(s)+H2O(g)=CO(g)+H2 (g) ? ΔH 1 = +131 kJ/mol
CO(g) + H2O(g)=CO2 (g)+ H2(g) ? ΔH 2 = ?41 kJ/mol
CO(g) + 3H2 (g)=CH4 (g)+ H2O(g) ? ΔH 3 = ?206 kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式??????????????????????????????????? 。
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有???????????????????? 。
(3)写出甲烷—空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式?????????????????????? 。
II. 对以上反应CO(g) + H2O(g)  CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
实验编号 | 容器体积/L | 温度/°C |
① | 2.0 | 1200 |
② | 2.0 | 1300 |
③ | 1.0 | 1200 |
(1)实验①中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,画出实验②和③中c(CO2)随时间变化关系的预期结果示意图。

(2)在与实验①相同的条件下,起始时充入容器的物质的量:n(CO)=n(H2O)=n(CO2) =n( H2)=1.00mol。通过计算,判断出反应进行的方向。(写出计算过程。)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省淄博市高三复习阶段性检测(二模)理科综合化学试卷(解析版) 题型:填空题
(1)写出CO2+离子基态的价电子排布式:__________________________________。
(2)SO32-的空间构型是:___________________________________________。
(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:_______________。
(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化。该晶体中存在的作用力有:__________________。
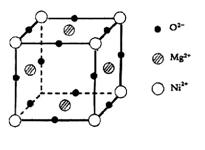
(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示。在晶体中,每个Ni2+离子与_____________个Mg2+离子配位。该晶体的化学式是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——物质结构与性质】
(1)写出CO2+离子基态的价电子排布式:__________________________________。
(2)SO32-的空间构型是:___________________________________________。
(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:_______________。
 (4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化。该晶体中存在的作用力有:__________________。
(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化。该晶体中存在的作用力有:__________________。
(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示。在晶体中,每个Ni2+离子与_____________个Mg2+离子配位。该晶体的化学式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为___________ 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
 (3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN![]() N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将_________能转化为___________能。其电极反应式分别为:
负极_________________________,正极_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com