
【题目】现有14.4gCO和CO2的混合气体,在标准状况下其体积为8.96L。
(1)该混合气体的平均摩尔质量为____。
(2)混合气体中碳原子的个数为____(用NA表示阿伏加德罗常数)。
(3)将混合气体依次通过下列装置,最后收集在气球中(实验在标准状况下测定)。

①气球中收集到的气体的摩尔质量为____。
②气球的体积为____L。
【答案】36g·mol-1 0.4NA 28g·mol-1 4.48
【解析】
设CO和CO2的物质的量分别为xmol、ymol,则列方程组:28x+44y=14.4,x+y=![]() mol,解之得x=0.2,y=0.2,气体共为0.4mol,则
mol,解之得x=0.2,y=0.2,气体共为0.4mol,则
(1)根据M=m/n可知,该混合气体的平均摩尔质量为14.4g÷0.4mol=36g/mol;
答案是:36g/mol;
(2)CO和CO2中碳原子的物质的量为0.2mol×1+0.2mol×1=0.4mol,碳原子的个数为0.4mol×NA=0.4NA;
故答案是:0.4NA;
(3)将混合气体依次通过如图所示装置,二氧化碳与氢氧化钠反应,经浓硫酸干燥,得到的气体为CO,
①气球中收集到的气体为CO,摩尔质量为28g/mol;
故答案是:28g/mol;
②气球中收集到的气体为CO,标况下体积V=0.2mol×22.4L/mol=4.48L;
故答案是:4.48。


科目:高中化学 来源: 题型:
【题目】2019年政府工作报告提出要持续开展大气污染的治理攻坚。下列不属于大气污染防治措施的是
A.  向酸性土壤中加入熟石灰
向酸性土壤中加入熟石灰
B.  汽车尾气净化减排
汽车尾气净化减排
C.  工业尾气回收处理
工业尾气回收处理
D.  用清洁能源替代化石燃料
用清洁能源替代化石燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为CuCO3·Cu(OH)2某同学设计从孔雀石中冶炼铜的方案如下:

回答下列问题:
(1)将孔雀石粉碎的目的是_________,加入过量稀硫酸,可观察到的现象是_________
(2)操作a的名称是________,在滤液中加入过量铁粉发生的反应有_______________(用离子方程式表示)
(3)A的化学式为_________,在悬浊液中加入A的目的是___________
(4)从滤液中获得铜的另外一种方案是:2CuSO4+ 2H2O![]() 2Cu+O2↑+2H2SO4现有111 kgCuCO3·Cu(OH)2,通过这种方案理论上可以制取_________kg铜
2Cu+O2↑+2H2SO4现有111 kgCuCO3·Cu(OH)2,通过这种方案理论上可以制取_________kg铜
(5)请你根据提供的试剂,设计由孔雀石冶炼铜的另外一种方案(请用简洁的文字说明)__________(可供选择试剂:铁粉稀硫酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SO2的相对分子质量为___,其摩尔质量为____。
(2)标准状况下,0.5 mol任何气体的体积都约为____。
(3)4gH2与标准状况下22.4LSO2相比,所含分子数目较多的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
(1)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有___________种。基态Ti2+的最外层电子排布式为______________________。
(2)铝的逐级电离能数据为:I1=580kJ/mol、I2=1820 kJ/mol、I3=2750 kJ/mol、I4=11600kJ/mol。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在___________之间(用I1、I2、I3……等填空)
(3)已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是___________(填化学式),理由是___________。
(4)催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。

①M中,碳原子的杂化类型有___________。
②M中,不含___________(填标号)
A.π键 B.σ键 C.配位键 D.氢键 E.离子键
(5)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AIH4-空间构型相同的一种分子___________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有___________个:NaAlH4晶体的密度为___________g/cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是

A. 当有0.2 mol电子转移时,a极产生3.2g O2
B. b极上发生的电极反应是:2 H+ +2e- = H2↑
C. c极上进行还原反应,B中的H+可以通过隔膜进入A
D. d极上发生的电极反应是:O2+2H2O + 4e- = 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①标准状况下,1LHCl和1LH2O的物质的量相同;
②常温常压下,1gH2和14gN2的体积相同;
③28gCO的体积为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A. ①③④⑥B. ②⑤⑥C. ⑤⑥D. ①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
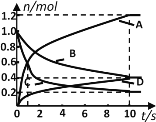
A. 反应进行到1s时,v (A)=v (C)
B. 反应进行到10s时,各物质的反应速率相等
C. 反应进行到10s时,A的平均反应速率为0.06 mol/(L·s)
D. 该反应的化学方程式为6A+3B![]() 4C+2D
4C+2D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com