
| A. | 5.0 m o l/L | B. | 4.0 m o l/L | C. | 4.5 m o l/L | D. | 3.0 m o l/L |
分析 氯化铁与硫化氢发生反应:2Fe3++H2S=2Fe2++S↓+2H+,与Fe发生反应:2Fe3++Fe=3Fe2+,由于Fe过量,生成的盐酸再和铁反应生成氯化亚铁,最终溶液为FeCl2溶液,最终溶液中0.6mol金属离子为Fe2+,根据氯离子守恒计算n(FeCl3),进而计算其物质的量浓度.
解答 解:氯化铁与硫化氢发生反应:2Fe3++H2S=2Fe2++S↓+2H+,与Fe发生反应:2Fe3++Fe=3Fe2+,由于Fe过量,生成的盐酸再和铁反应生成氯化亚铁,最终溶液为FeCl2溶液,最终溶液中0.6mol金属离子为Fe2+,
根据氯离子守恒:3n(FeCl3)=2n(FeCl2),即n(FeCl3)=$\frac{2}{3}$n(FeCl2)=0.6mol×$\frac{2}{3}$=0.4mol,
故原溶液中c(FeCl3)=$\frac{0.4mol}{0.1L}$=4mol/L,
故选B.
点评 本题考查混合物有关计算,明确发生的反应是解题关键,利用守恒法解答,避免方程式的繁琐,侧重考查学生分析计算能力,难度中等.


科目:高中化学 来源: 题型:解答题
 表示某粒子的结构示意图.
表示某粒子的结构示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
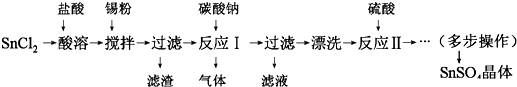
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
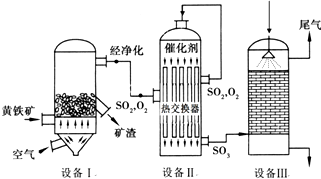
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

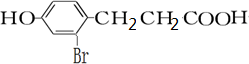 .
.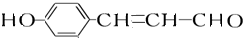 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$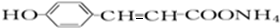 +2Ag↓+3NH3+H2O,反应类型为氧化反应.
+2Ag↓+3NH3+H2O,反应类型为氧化反应.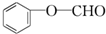 ,
,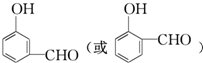 .
. +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液与稀硫酸的反应:OH-+H+=H2O | |
| C. | 用FeCl3溶液腐蚀印刷电路板上铜箔:2Fe3++Cu=2Fe+Cu2+ | |
| D. | 碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有④ | B. | 只有⑤ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
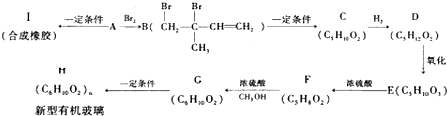
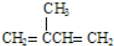 (不考虑立体异构),由G生成H的反应类型是加聚反应;
(不考虑立体异构),由G生成H的反应类型是加聚反应;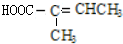 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$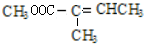 +H2O.与F具有相同官能团且比F少一个碳原子的有机物的同分异构体有3种(不考虑立体异构);
+H2O.与F具有相同官能团且比F少一个碳原子的有机物的同分异构体有3种(不考虑立体异构);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com