
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
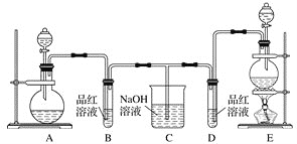
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4===Na2SO4+H2O+SO2↑
MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是________(填字母),反应中浓盐酸所表现出的化学性质是________________和________________。
(2)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,__________(填“B”或“D”)试管中无明显现象。
(3)装置C的作用是____________________。
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是__________________。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是____________________________。
【答案】E 还原性 酸性 D 吸收多余的二氧化硫和氯气 先变红,后褪色 SO2+Cl2+2H2O===2HCl+H2SO4
【解析】
(1)根据反应物的状态和反应条件选择反应装置,根据氯元素的化合价变化和生成物分析浓盐酸的性质;
(2)根据二氧化硫和次氯酸的漂白原理分析;
(3)根据二氧化硫和氯气均是大气污染物分析;
(4)根据氯水的性质分析;
(5)根据氯气能和二氧化硫在溶液中反应生成盐酸和硫酸解答。
(1)根据题给信息知,实验室制取氯气所用药品是固体和液体,反应条件是加热,所以应选用固液加热型装置,选E;实验室制取氯气的反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价降低,所以浓盐酸所表现出的性质是酸性和还原性;
MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价降低,所以浓盐酸所表现出的性质是酸性和还原性;
(2)氯气通入品红溶液中红色褪去,是利用次氯酸的强氧化性,生成的无色物质稳定,加热不复原;二氧化硫的漂白性是利用二氧化硫和有色物质化合生成无色物质,生成的无色物质不稳定,加热复原,因此D试管中无明显现象;
(3)氯气和二氧化硫均有毒不能直接排放到空气中,需进行尾气处理,装置C的作用是吸收多余的SO2和Cl2防止污染环境;
(4)氯气溶于水生成盐酸和次氯酸,氯水显酸性和强氧化性,因此若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是先变红,后褪色;
(5)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应生成盐酸和硫酸而使气体失去漂白性,反应方程式为Cl2+SO2+2H2O=H2SO4+2HCl。


科目:高中化学 来源: 题型:
【题目】C、N、O、Na、Mg、Al、S、Cl是常见的八种元素,根据元素及其化合物性质,回答下列问题:
(1)S在周期表中的位置为______;CO2的电子式是_______。
(2)比较O、Na元素常见离子的半径大小(用化学式表示,下同)____>____;__________比较S、Cl元素的最高价氧化物对应水化物的酸性强弱:____>____ 。_______________
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的结构简式为______;Q的化学式为_______ 。
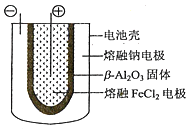
(5)熔融状态下,钠和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2![]() Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是
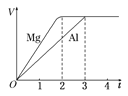
A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。
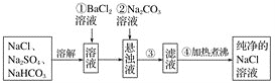
如果此方案正确,那么:
(1)操作①为什么不用硝酸钡溶液,其理由是___________________________________。
(2)进行操作①后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(3)操作②的目的是________,为什么不先过滤后加碳酸钠溶液?理由是________________________________________________________________________。
(4)操作③用到的玻璃仪器除烧杯、玻璃棒外,还需要____________________。
(5)操作④的目的是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 加压有利于SO2与O2反应生成SO3 B. 500度左右比常温下更有利于合成氨
C. 将氨气液化,有利于合成氨的反应 D. 用过量空气煅烧硫铁矿可以提高原料利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中CO2含量的增加会加剧温室效应,秉承“低碳环保,绿色出行”的生活理念,CO2的综合利用也成为热门研究领域。
I.CO2可用于生产乙烯。
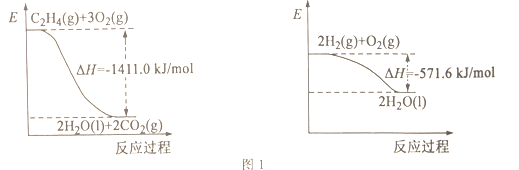
(1)依据图1写出CO2和H2生成C2H4和H2O(l)的热化学方程式________。
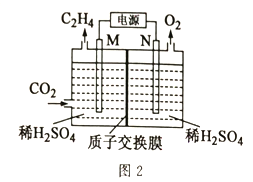
(2)以稀硫酸作电解质溶液,利用电解法将CO2转化为乙烯的装置如图2所示。M电极的电极反应式为_____,工作一段时间后,阳极室中溶液的pH_____(填“增大”“不变”或“减小”)。
Ⅱ.CO2与H2在一定条件下可生产二甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)Δ H<0
CH3OCH3(g)+3H2O(g)Δ H<0
(3)在2.0L恒容密闭容器中,加入2.0molCO2和6.0molH2,恒温条件下经过5min达到平衡状态,此时的压强是起始压强的2/3
①0~5min内反应的平均速率v(H2)=____,此温度下的平衡常数K=______.
②平衡常数K(800K)______K(900K)(填“>”“=”或“<”)
(4)分别以Cat.1和Cat.2作催化剂发生该反应,反应进行相同的时间后,测得CO2的转化率a(CO2)随反应温度T的变化情况如图3所示(忽略温度对催化剂活性的影响)。
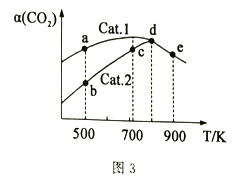
①该反应的活化能Ea(Cat.1)________Ea(Cat.2)(填“>”或“<”)。
②a、b、c、d、e五个状态中一定是平衡状态的是_______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,原子半径依次增大。W、X在同一主族,Y元素在第三周期中离子半径最小,Y和Z的原子序数之和是W的3倍。下列说法正确的是
A. X的简单氢化物的热稳定性比W的强 B. X的氧化物对应的水化物是强酸
C. Z和W形成的化合物可能含有非极性键 D. Z、Y的氧化物是常用的耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
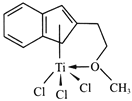
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。

①A、B、C、D 4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com