
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A. ①④⑥B. ①②④C. ②③⑤D. ③⑤⑥
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】关于反应CH3COOH(l) + C2H5OH(l) ![]() CH3COOC2H5(l) + H2O(l) ΔH=-2.7kJ·mol-1,下列说法正确的是
CH3COOC2H5(l) + H2O(l) ΔH=-2.7kJ·mol-1,下列说法正确的是
A.由于水为液态,移走生成的水平衡不会移动。
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新能源汽车上有一种质子交换膜燃料电池,其工作原理如图所示,下列叙述正确的( )
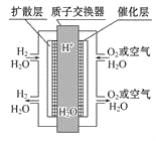
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.总反应式为O2+2H2![]() 2H2O
2H2O
D.正极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色,可用作晒制蓝图。某实验小组对纯净草酸亚铁晶体热分解气体产物成分的进行探究。小组成员采用如图装置(可重复选用)进行实验:
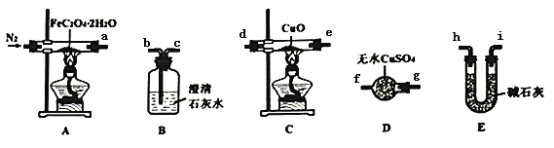
请回答下列问题:
(1)E中盛装碱石灰的仪器名称为___。
(2)D中的现象是___,是为了证明草酸亚铁晶体分解产物中可能含有___。
(3)按照气流从左到右的方向,上述装置的接口顺序为a→g→f→___→尾气处理装置(仪器可重复使用)。
(4)实验前先通入一段时间N2,其目的为___。
(5)实验证明了气体产物中含有CO,依据的实验现象为___。
(6)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。W、X、Y、Z均为短周期元素,原子序数依次增加,其中W、X、Z组成的化合物M、N、R之间存在如图所示的反应。下列叙述正确的是
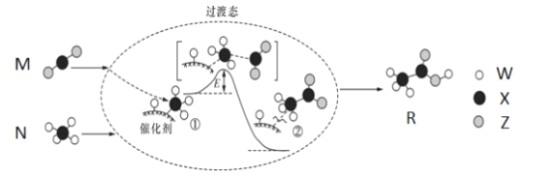
A.元素非金属性的顺序为X>Y>Z>W
B.M、N、R三种分子中,所有原子均满足8电子稳定结构
C.M、N、R三种分子均含有极性键和非极性键
D.W、X、Y、Z四种元素既可形成离子化合物,又可形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正确的是( )
途径①:S![]() H2SO4
H2SO4
途径②:S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
途径③:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①的反应中体现了浓硝酸的强氧化性
B. 途径②、③的第二步反应在实际生产中可以通过增大氧气的浓度来降低成本
C. 由途径①、②、③分别制取1 mol 硫酸,理论上各消耗1 mol 硫,各转移6 mol 电子
D. 途径②、③比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业中,人们常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并回收Cu和综合利用FeCl3溶液。实验室模拟流程如图所示:
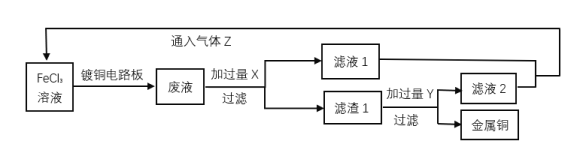
回答下列问题:
(1)过滤操作除铁架台(附铁圈)、烧杯、滤纸外还需要的仪器为___。
(2)滤渣1成分的化学式为___;试剂Y为___。
(3)可替代气体Z的试剂为___(填序号)
A.硝酸 B.酸性高锰酸钾 C.过氧化氢
(4)写出FeCl3溶液腐蚀覆铜板的离子方程式___。
(5)用实验证明滤液1中只含有Fe2+___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种常用的化工原料,经常可以用来转化成高附加值的CO、CH4、CH3OH、CO(NH2)2等一碳(C1)产物。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示。该反应的ΔH___(填“>”、“<”或“=”,下同)0,若y表示压强,则y1___y2,若y表示反应开始时的氨碳比[
CO(NH2)2(s)+H2O(g)。在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示。该反应的ΔH___(填“>”、“<”或“=”,下同)0,若y表示压强,则y1___y2,若y表示反应开始时的氨碳比[![]() ],则y1__y2。
],则y1__y2。

Ⅱ.CO2加氢过程,主要发生的三个竞争反应为:
反应i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H=-49.01kJmol-1
CH3OH(g)+H2O(g) H=-49.01kJmol-1
反应ii:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) H=-165.0kJmol-1
CH4(g)+2H2O(g) H=-165.0kJmol-1
反应iii:CO2(g)+H2(g)![]() CO(g)+H2O(g) H=+41.17kJmol-1
CO(g)+H2O(g) H=+41.17kJmol-1
回答下列问题:(1)由CO、H2合成甲醇的热化学方程式为__。
(2)如图是某甲醇燃料电池工作的示意图。

质子交换膜(只有质子能够通过)左右两侧的溶液均为1L2mol·L-1H2SO4溶液。电极a上发生的电极反应为___,当电池中有1mole发生转移时左右两侧溶液的质量之差为___g(假设反应物耗尽,忽略气体的溶解)。
(3)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按![]() =3∶1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
=3∶1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
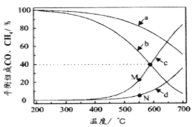
则表示1MPa时CH4和CO平衡组成随温度变化关系的曲线分别是___、___。M点所表示物质的平衡组成高于N点的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是 ( )

A. OH—+HCl=H2O+C1—
B. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+CuCl2=Cu+FeCl2
D. Fe+2H+=Fe2++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com