
| A、H2O |
| B、NH3 |
| C、O2 |
| D、CO2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
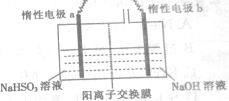 连二亚硫酸钠(Na2S2O4)俗称保险粉,具有强还原性,广泛用于纺织品漂白及作脱氧剂等.
连二亚硫酸钠(Na2S2O4)俗称保险粉,具有强还原性,广泛用于纺织品漂白及作脱氧剂等.查看答案和解析>>
科目:高中化学 来源: 题型:
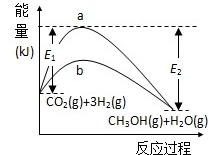 一定条件下发生反应:
一定条件下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol氖气含Ne原子数为2NA |
| B、标准状况下,22.4L氨气中所含的氢原子总数为3NA |
| C、1L 1mol?L-1的盐酸中含HCl的分子数为NA |
| D、1mol由O2和CO2组成的混合气体中,含氧原子的总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配置FeCl3溶液时加入少量浓盐酸 |
| B、加热有利于纯碱溶液去油污 |
| C、500°C比常温更有利于合成氨 |
| D、醋酸溶液与锌反应放出H2,加入适量醋酸钠晶体可以减慢放出H2的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、①② |
| C、②③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用水洗涤2~3次后再使用 |
| B、用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同再使用 |
| C、用盐酸洗涤,再用自来水洗净后使用 |
| D、用滤纸擦干净即可使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.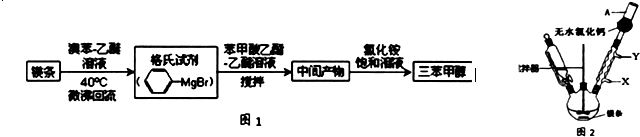
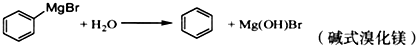
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,溶于乙醇、醚等多数有机溶剂 | |
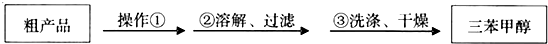
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com