
| A、FeCl3溶液滴入KI淀粉溶液后,溶液变蓝 |
| B、纯碱溶液中滴入少量氯水后生成次氯酸、氯化钠等 |
| C、NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3- |
| D、向FeI2溶液中滴加少量溴水,反应的离子方程式为:2I-+Br2=I2+2Br- |


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
A、H2S的电子式: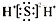 |
B、基态氧原子的电子排布图: |
| C、二氧化硅的分子式:SiO2 |
| D、24Cr的电子排布式:[Ar]3d54s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
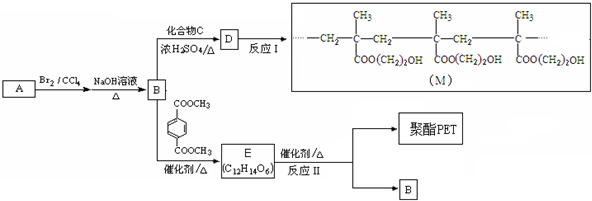
18 |
| 催化剂 |
| △ |
18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 180~200℃ |
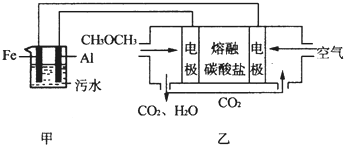
查看答案和解析>>
科目:高中化学 来源: 题型:
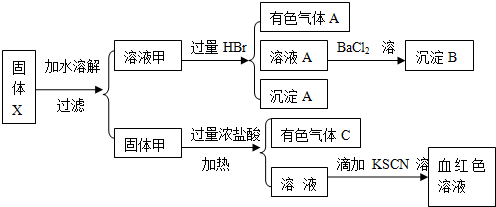 根据上述实验,以下说法正确的是( )
根据上述实验,以下说法正确的是( )| A、原混合物中一定不含有MgCl2 |
| B、气体A的成分可能超过2种 |
| C、溶液甲中一定含有Na2SiO3、NaNO2、K2SO4可能含有K2CO3、K2SO3 |
| D、固体甲中除MnO2外,可能只含有FeO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com