
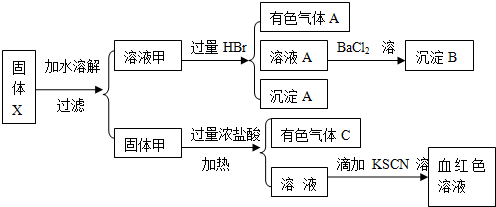
 根据上述实验,以下说法正确的是( )
根据上述实验,以下说法正确的是( )| A、原混合物中一定不含有MgCl2 |
| B、气体A的成分可能超过2种 |
| C、溶液甲中一定含有Na2SiO3、NaNO2、K2SO4可能含有K2CO3、K2SO3 |
| D、固体甲中除MnO2外,可能只含有FeO |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、FeCl3溶液滴入KI淀粉溶液后,溶液变蓝 |
| B、纯碱溶液中滴入少量氯水后生成次氯酸、氯化钠等 |
| C、NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3- |
| D、向FeI2溶液中滴加少量溴水,反应的离子方程式为:2I-+Br2=I2+2Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
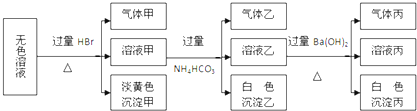
| A、沉淀甲可能是AgBr |
| B、沉淀丙一定是BaCO3 |
| C、气体甲的成份只有4种可能 |
| D、肯定存在的离子有AlO2-、S2-、SO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某溶液中可能含有的离子如下表:
某溶液中可能含有的离子如下表:| 可能大量含有的阳离子 | H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、CO32-、[Al(OH)4]-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 | 150 | 200 |
| 溶解度(g/100gH2O) | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.11 | 0.092 | 0.074 | 0.034 | 0.012 |
| A、氢氧化钙的溶解是放热过程 |
| B、100℃时氢氧化钙的Kxp约等于4×10-6 |
| C、温度升高时氢氧化钙溶解速率加快 |
| D、100℃时pH=12的溶液中c(Ca2+)≤0.04mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾和FeCl3可作净水剂 |
| B、为保存FeCl3溶液,要在溶液中加少量盐酸 |
| C、用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 |
| D、氢氟酸用塑料试剂瓶保存而不用玻璃试剂瓶保存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com