
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 | 150 | 200 |
| 溶解度(g/100gH2O) | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.11 | 0.092 | 0.074 | 0.034 | 0.012 |
| A、氢氧化钙的溶解是放热过程 |
| B、100℃时氢氧化钙的Kxp约等于4×10-6 |
| C、温度升高时氢氧化钙溶解速率加快 |
| D、100℃时pH=12的溶液中c(Ca2+)≤0.04mol?L-1 |
| 0.074g |
| 74g/mol |
| Ksp |
| c2(OH-) |
| 4×10-6 |
| 1 |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
 次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性.
次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
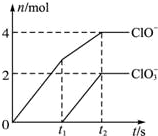 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2═5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2═5CaCl2+Ca(ClO3)2+6H2O.| c(ClO-) | ||
n(Cl
|
查看答案和解析>>
科目:高中化学 来源: 题型:
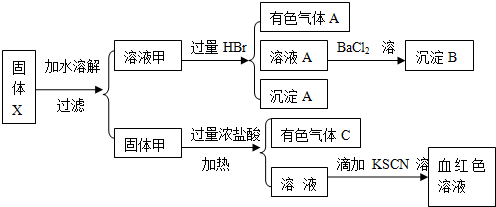 根据上述实验,以下说法正确的是( )
根据上述实验,以下说法正确的是( )| A、原混合物中一定不含有MgCl2 |
| B、气体A的成分可能超过2种 |
| C、溶液甲中一定含有Na2SiO3、NaNO2、K2SO4可能含有K2CO3、K2SO3 |
| D、固体甲中除MnO2外,可能只含有FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 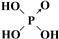 | 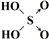 | 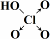 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
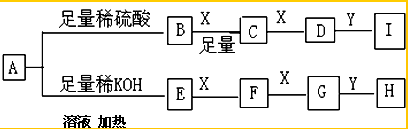
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com