
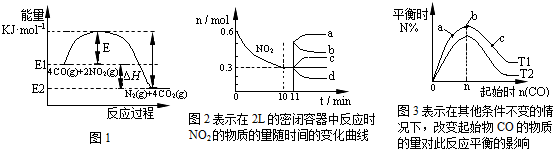
| A、在一定温度、固定容积的密闭容器里,混合气体的密度不再改变可以说明上述可逆反应已达平衡 | B、由图1可得加入适当的催化剂,E和△H都减小 | C、图2中0~10min内该反应的平均速率v(CO)=0.03mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(NO2)的变化曲线为d | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
| ||
| △t |
| ||
| 10min |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
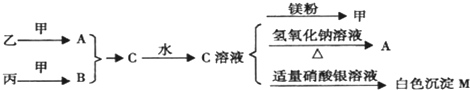
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com