


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 结论 |
| ①将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中 | _ | _ |
| ②向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解. | 固体完全溶解 | 证明猜想 |
| ③向另一试管中加入足量的 | 固体完全溶解 | 猜想 |
| 得出结论:综合实验②③的现象,可推知猜想 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| O2,Zn/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.5 mol?L-1 |
| B、4 mol?L-1 |
| C、4.5 mol?L-1 |
| D、5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
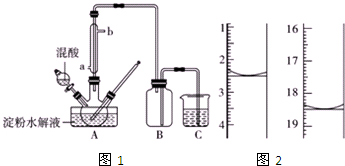 淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热,搅拌和仪器固定装置均已略去)
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热,搅拌和仪器固定装置均已略去)查看答案和解析>>
科目:高中化学 来源: 题型:
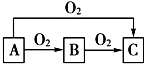 ABC是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去),回答下列问题:
ABC是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、虽然药物能治病,但大部分药物有毒副作用 |
| B、使用青霉素时,直接静脉注射可以不用进行皮肤敏感试验 |
| C、长期大量使用阿司匹林可预防疾病,没有副作用 |
| D、麻黄碱有镇静催眠的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1.0×10-14 | α | 1.0×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com