
A、
| ||
B、
| ||
C、
| ||
D、
|
| n |
| V |
| 2ymol-4xmol |
| aL |
| 2y-4x |
| a |


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
| A、①②③ | B、②③④ |
| C、①②④ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[N(CH3)4]+中只含共价键 |
| B、该反应中,SO2作氧化剂 |
| C、SO2漂白品红是利用其强氧化性 |
| D、每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳原子数 | B、氢原子数 |
| C、质量 | D、密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol?L-1硫酸钾溶液中阴离子所带电荷数为NA | ||
| B、标准状况下,11.2L氟化氢中含有的氟原子数为0.5NA | ||
C、a g乙烯和环戊烷的混合气中含有极性键数目是
| ||
| D、氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
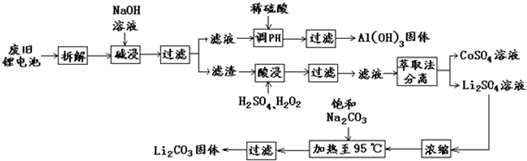
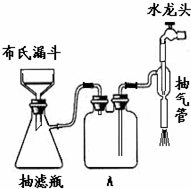
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com