
| ||
| ||
| ||
 ,故答案为:
,故答案为: ;
;

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
 用试纸检验气体性质是一种重要的实验方法.如图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )
用试纸检验气体性质是一种重要的实验方法.如图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )| 选项 | 试剂B | 湿润的试纸A | 现象 | 结论 |
| A | 新制氯水 | PH试纸 | 变白 | 氯气具有漂白性 |
| B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气显碱性 |
| C | Na2SO3,硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| D | Cu,浓硝酸 | KI淀粉试纸 | 变蓝 | NO2为酸性气体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
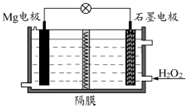 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A、Mg 电极是该电池的正极 |
| B、H2O2 在石墨电极上发生氧化反应 |
| C、石墨电极上的电极反应式为:H2O2+2e-=2OH- |
| D、导线中电子由正极流向负极,溶液中Cl-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2S(g)+O2(g)=2S (s)+2H2O(l)△H=-Q2 kJ/mol | ||
| B、CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ/mol | ||
C、CO(g)+
| ||
| D、2H2(g)+O2(g)═2H2O(1);△H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Y>Z>W |
| B、XW2熔点为107℃,沸点为142.5℃,说明固态XW2为分子晶体 |
| C、电解YW3固体可得单质Y |
D、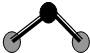 ZW2分子结构见右图,说明ZW2是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| B、铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率 |
| C、其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积 |
| D、能与酸反应的氧化物,一定是碱性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com