
【题目】(多选)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)
B.转移电子的物质的量为1.25 mol
C.有0.250 mol KNO3被氧化
D.被氧化的N原子的物质的量为3.75 mol
【答案】BD
【解析】解:10NaN3+2KNO3═K2O+5Na2O+16N2↑中N元素化合价由﹣ ![]() 、+5价变为0价,所以NaN3是还原剂、KNO3是氧化剂,N2既是氧化产物又是还原剂,根据反应方程式可知,每当生成16molN2 , 则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,现氧化产物比还原产物多1.75mol,则生成2molN2 , 转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,A.生成2molN2 , 在标准状况下的体积为44.8L,故A错误;
、+5价变为0价,所以NaN3是还原剂、KNO3是氧化剂,N2既是氧化产物又是还原剂,根据反应方程式可知,每当生成16molN2 , 则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,现氧化产物比还原产物多1.75mol,则生成2molN2 , 转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,A.生成2molN2 , 在标准状况下的体积为44.8L,故A错误;
B.转移电子的物质的量为0.25mol×(5﹣0)=1.25mol,故B正确;
C.由反应可知,被还原的硝酸钾的物质的量为2mol× ![]() =0.25mol,故C错误;
=0.25mol,故C错误;
D.转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为 ![]() mol=3.75mol,故D正确;
mol=3.75mol,故D正确;
故选BD.


科目:高中化学 来源: 题型:
【题目】CH4、NH3、H2O、H2S、NH4NO3和ZnS是中学化学常见的六种化合物。回答下列问题:
(1)基态S原子有__________种不同能量的电子,与Zn同属ds区且同周期的元素基态原子核外电子排布式为____________________。
(2)H2O和H2S中,沸点较高的是__________,原因是___________________________________。
(3)CH4、NH3和H2O3种氢化物中,键角由大到小的顺序为_______________,其中NH3的VESEPR模型名称为____________。
(4)NO3-离子的几何构型为__________,NO3-离子的电子体有_____________(任写一种)。
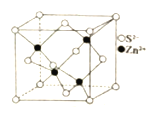
(5)ZnS晶体结构有多种,其中一种晶体的晶胞结构如图所示,晶体中与S2-等距离且最近的S2-有_____个。已知该晶体的晶胞参数为anm,其密度为 ρg·cm-3,则阿伏加德罗常数的数值为____________________________(用含字母a、ρ的表达式表示,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的一些问题常涉及化学知识.下列叙述中,正确的是( )
A. “非典”元凶冠状病毒是一种油脂
B. 我们所吃的豆腐中主要含有蛋白质
C. 棉花和蚕丝的主要成分都是纤维素
D. 糯米中的淀粉一经发生水解反应就酿造成酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示。下列有关说法正确的是

A. 实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
B. 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
C. 沉淀乙一定有BaCO3,可能有BaSO4
D. 一定没有Fe3+,但是无法确定是否含有I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室用密度为1.25 g·mL-1,质量分数为36.5%的浓盐酸配制240 mL 0.1 mol·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为____________。
(2)配制240 mL 0.1 mol·L-1的盐酸应量取浓盐酸体积________。
(3)配制该溶液时除了使用烧杯、玻璃棒、量筒,还需要的玻璃仪器为____________________。
Ⅱ.在溶液的配制过程中会引起浓度偏高的是_____________
①用1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸;
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线;
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液;
④向80 mL水中加入18.4 mol·L-1硫酸20 mL,配制3.68 mol·L-1的硫酸溶液;
⑤质量分数为5x%和x%的两种氨水等体积混合配制成3x%的氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的容器中进行反应:2X(g) ![]() 2Y(g) + Z(g)中,X的浓度由0.3 mol/L降到0.14mol/L需要20s,那么由0.14 mol/L降到0.06mol/L需要的时间为( )
2Y(g) + Z(g)中,X的浓度由0.3 mol/L降到0.14mol/L需要20s,那么由0.14 mol/L降到0.06mol/L需要的时间为( )
A. 等于10s B. 大于10s
C. 小于10s D. 等于8s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的不断发展促进社会的进步。
(1)“天宫二号”内大量使用了碳纤维复合材料,在碳纤维复合材料中,碳纤维属于_____(填“增强剂”或“基体”);聚乙烯塑料常用于食品包装,聚乙烯塑料属于_________(填“热固性”或“热塑性”)塑料。硫化橡胶具有较高的强度和化学稳定性,它具有___________结构。天然橡胶的结构简式是________(填字母)。
 c. (C6H10O5)n
c. (C6H10O5)n
钢铁生锈的负极电极反应式为:_________________________。
(2)2015年某研究机构用一种新材料镍纳米粒子作催化剂,将二氧化碳和氢气在加热条件下转化为甲烷,该反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。

回答下列问题:
(1)CeFCO3中Ce的化合价为___________。
(2)氧化培烧时不能使用陶瓷容器,原因是_________________。氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为____________________。操作Ⅰ的名称为_________。
(3)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) ![]() CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:____________________。
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:____________________。
(5)298K时,向c(Ce3+)=0.02mol·L-1的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Ce3+是否沉淀完全?__________________{列式计算,已知:Ksp[Ce(OH)3]5×l0-20,c(Ce3+)-5mol·L-1 视为沉淀完全}。
(6)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com