
����Ŀ��CH4��NH3��H2O��H2S��NH4NO3��ZnS����ѧ��ѧ���������ֻ�����ش��������⣺
��1����̬Sԭ����__________�ֲ�ͬ�����ĵ��ӣ���Znͬ��ds����ͬ���ڵ�Ԫ�ػ�̬ԭ�Ӻ�������Ų�ʽΪ____________________��
��2��H2O��H2S�У��е�ϸߵ���__________��ԭ����___________________________________��
��3��CH4��NH3��H2O3���⻯���У������ɴ�С��˳��Ϊ_______________������NH3��VESEPRģ������Ϊ____________��
��4��NO3-���ӵļ��ι���Ϊ__________��NO3-���ӵĵ�������_____________����дһ�֣���
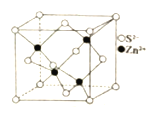
��5��ZnS����ṹ�ж��֣�����һ�־���ľ����ṹ��ͼ��ʾ����������S2-�Ⱦ����������S2-��_____������֪�þ���ľ�������Ϊanm�����ܶ�Ϊ ��g��cm-3�����ӵ���������ֵΪ____________________________���ú���ĸa�����ı���ʽ��ʾ���г�����ʽ���ɣ���
���𰸡� 5 [Ar]3d104s1����1s22s22p63s23p63d104s1�� H2O H2O���Ӽ����γ���� CH4��NH3��H2O �������������������� ƽ�������� CO32-��SiO32-��SO3��BF3�� 12 ![]()
����������1��S�ĺ����������16����������Ų�ʽΪ1s22s22p63s23p4�����Ի�̬Sԭ����5�ֲ�ͬ�����ĵ�������Znͬ��ds����ͬ���ڵ�Ԫ����ͭ��ͭ��ԭ��������29�����ݺ�������Ų����ɿ�֪���̬ԭ�Ӻ�������Ų�ʽΪ [Ar]3d104s1����2������H2O���Ӽ����γ���������Էе�ϸߵ���H2O����3��CH4��NH3��H2O�������ʵĿռ乹�ͷֱ����������塢�����κ�V�Σ�������ɴ�С��˳��ΪCH4��NH3��H2O�����ڰ��������е�ԭ�Ӻ���һ�Թ¶Ե�������NH3��VESEPRģ������Ϊ�������Ρ���4��NO3������������ԭ�ӵļ۲���Ӷ�����3+(5+1-3��2)/2��3�������ڹ¶Ե��ӣ�����������ļ��ι���Ϊƽ�������Σ�ԭ�����ͼ۵������ֱ���ȵĻ�Ϊ�ȵ����壬����NO3�����ӻ�Ϊ�ȵ�������CO32����SiO32����SO3��BF3�ȡ���5��������п�ľ����ṹ��֪��������S2���Ⱦ����������S2��λ�����Ĵ���������12���������������Ӹ�����8��1/8+6��1/2��4��п����ȫ���ھ����У�Ҳ��4������֪�þ���ľ�������Ϊanm�����ܶ�Ϊ ��g��cm��3����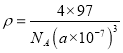 �����
�����![]() ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. 1 mol CO2������Ϊ44g��mol��1
B. CO2��Ħ������Ϊ44g
C. 6.02��1022��CO2���ӵ�����Ϊ4.4g
D. 1mol�κ����ʵ��������ڸ����ʵ���Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��9.5gMgCl2��������ˮ���500mL��Һ�������ʵ����ʵ���Ϊ �� ��Ũ��ΪmolL��1 �� ����ȡ��100mL��Һ������Cl����Ũ��ΪmolL ��1���ٰ�ȡ������Һ��ˮϡ�ͳ�500mL�����ʱMgCl2��Һ��Ũ��ΪmolL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(NH4)2Cr2O7��һ�������ֽ���Σ����и����(NH4)2Cr2O7���ȷֽ������жϿ�����ȷ����
A. CrO3 + NH3 + H2 B. Cr2O3 + NH3 + H2O
C. CrO3 + N2 + H2O D. Cr2O3 + N2 + H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ȥ�����е�Ca2+��Mg2+��SO42���Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£����ڳ������Լ��Թ������� ��ȡ���� ![]()
![]()
![]()
![]()
![]() ��Һ
��Һ ![]()
![]() ����
����
��1���ڢٲ��У�����A�� �� �ڢݲ��У�����B�� ��
��2���ڢܲ��У�д����Ӧ�Ļ�ѧ����ʽ���������Һ��Ca2+����Ҫ������ʽΪCaCl2�� ��
��3�����ȼ��������ٹ��ˣ�����ʵ��������Ӱ�죬��ԭ���� ��
��4���ж�Na2CO3�ѹ����ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���������ȷ�Ӧ����
A.���ȷ�ӦB.�������ƺ������к�
C.������������������D.Ba(OH)2��8H2O������NH4Cl���巴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.ͬ��ͬѹ�£���ͬ��������ʣ������ʵ���һ�����
B.�����ʵ����ļ����һ����̼�����ķ�����һ�����
C.1Lһ����̼��������һ����1L����������С
D.��ͬ�����µ�CO�����NO���壬�������ȣ������ǵ�����һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������á��������� ![]() Pu��Ϊ��Դ���ϣ����й���
Pu��Ϊ��Դ���ϣ����й��� ![]() Pu��˵����ȷ���ǣ� ��
Pu��˵����ȷ���ǣ� ��
A.![]() Pu��
Pu�� ![]() U��Ϊͬλ��
U��Ϊͬλ��
B.![]() Pu��
Pu�� ![]() Pu��Ϊͬ��������
Pu��Ϊͬ��������
C.![]() Pu��
Pu�� ![]() U������ȫ��ͬ�Ļ�ѧ����
U������ȫ��ͬ�Ļ�ѧ����
D.![]() Pu��
Pu�� ![]() Pu������ͬ������������
Pu������ͬ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ������������ײʱ����ȫ�����з�����Ӧ10NaN3+2KNO3�TK2O+5Na2O+16N2��������������Ȼ�ԭ�����1.75mol���������ж���ȷ���ǣ� ��
A.����42.0 L N2����״����
B.ת�Ƶ��ӵ����ʵ���Ϊ1.25 mol
C.��0.250 mol KNO3������
D.��������Nԭ�ӵ����ʵ���Ϊ3.75 mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com