
【题目】![]() ,向20mL
,向20mL![]() 的
的![]() 溶液中滴加
溶液中滴加![]() 的NaOH溶液
的NaOH溶液![]() 滴定过程中溶液温度保持不变
滴定过程中溶液温度保持不变![]() ,滴定曲线如图1,含磷物种浓度所占分数
,滴定曲线如图1,含磷物种浓度所占分数![]() 随pH变化关系如图2,则下列说法不正确的是
随pH变化关系如图2,则下列说法不正确的是![]()
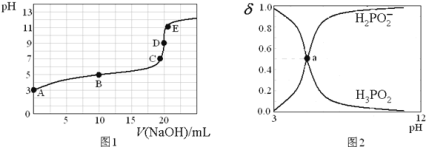
A.![]() 的电离方程式为:
的电离方程式为:![]() ;电离常数
;电离常数![]()
B.B点溶液中存在关系:![]()
C.图2中的a点对应为图1中的B点
D.D点时,溶液中微粒浓度大小关系为:![]()
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】某同学用中和滴定法测定某烧碱样品的纯度。实验步骤如下:
Ⅰ.配制待测液:用托盘天平称量5.0g烧碱样品(杂质不与盐酸反应),配制成1000mL溶液。
Ⅱ.滴定:取20.00mL所配待测液用0.10mol/L的盐酸标准液进行滴定,达到滴定终点后重复此操作两次。
Ⅲ.记录数据如下:
测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 20.00 | 0.50 | 20.64 |
2 | 20.00 | 1.20 | 24.32 |
3 | 20.00 | 1.30 | 21.40 |
请根据上述实验回答以下问题:
(1)配制待测液时,除烧杯和玻璃棒外,还需要用到的主要玻璃仪器有_____。
(2)盛装0.10mol/L的盐酸标准液应该使用____滴定管(选填“酸式”或“碱式”),滴定时眼睛应注意观察_____。
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,测定结果_____;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果____;
③读数时,滴定前俯视,滴定后仰视,测定结果_____。
(4)计算纯度:烧碱样品的纯度是_____(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
选项 | 实验目的 | 所选主要仪器 | 部分操作 |
A | 用浓硫酸配制480mL0.1molL-1硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸倒入容量瓶中,加水溶解至刻度线 |
B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、球形冷凝管、锥形瓶、牛角管 | 控制温度分别收集甲醇和甘油 |
D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的说法正确的是
A.0.1 L 0.5 mol·L-1 CH3COOH溶液中含有的H+数为0.05NA
B.室温下,稀释0.1 mol·L-1 CH3COOH溶液,溶液的导电能力增强
C.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中所有离子浓度均减小
D.CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的![]() 存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是
存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是

A.1个Ca2+周围距离最近且等距离的![]() 数目为4
数目为4
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.碳元素的单质有多种形式,如图依次是C60、石墨和金刚石的结构图:
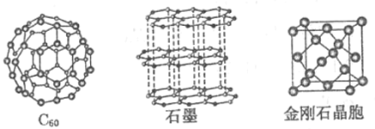
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_____________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为____________、____________。
(3)C、N、O三种元素的第一电离能由小到大的顺序是______________。
(4)C60属于_____________晶体,石墨属于_____________晶体。
(5)金刚石晶胞含有_____________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_____________a。
II.FeO晶体结构如下图所示,FeO晶体中Fe2+距离最近且相等的Fe2+有________个。若该晶胞边长为b cm,则该晶体的密度为_________g·cm-3。(用NA表示阿伏伽德罗常数)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,含碳微粒![]() 、
、![]() 、
、![]() 存在于
存在于![]() 草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数
草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数![]() 某微粒物质的量浓度与三种微粒物质的量浓度和比值
某微粒物质的量浓度与三种微粒物质的量浓度和比值![]() 与溶液pH的关系如图所示,下列有关说法错误的是
与溶液pH的关系如图所示,下列有关说法错误的是![]()
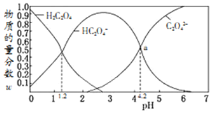
A.向![]() 的溶液中加NaOH溶液将pH增大至
的溶液中加NaOH溶液将pH增大至![]() 的过程中水的电离度一直增大
的过程中水的电离度一直增大
B.![]() 时,溶液中c
时,溶液中c![]()
![]()
![]()
C.![]() 若草酸的第二级电离平衡常数为
若草酸的第二级电离平衡常数为![]() ,则
,则![]()
D.将![]() 相同物质的量浓度
相同物质的量浓度![]() 和
和![]() 的两份溶液等体积混合,可配得图a点所示混合液
的两份溶液等体积混合,可配得图a点所示混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将![]() 气体通入aLbmo
气体通入aLbmo![]() 的NaOH溶液中,下列对所得溶液的描述不正确的是
的NaOH溶液中,下列对所得溶液的描述不正确的是![]()
A. 随着
随着 ![]() 气体的通入,溶液中由水电离出的
气体的通入,溶液中由水电离出的![]() 有如图变化关系
有如图变化关系
B.当![]() b时,所得溶液中存在:
b时,所得溶液中存在:![]()
C.当![]() b时,所得溶液中存在:
b时,所得溶液中存在:![]()
![]()
D.当![]()
![]() 时,所得溶液中一定存在:
时,所得溶液中一定存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆(主要成分为MnO2,含少量 Fe2O3、FeO、A12O3、SiO2等杂质)为原料制备锰酸锂的流程如下图所示。

(1)溶浸生产中为提高SO2回收率可采取的措施有_________(填序号)
a.不断搅拌,使SO2和软锰矿浆充分接触
b.增大通入SO2的流速
c.减少软锰矿浆的进入量
d.减小通入SO2的流速
(2)已知:室温下,Ksp[A1(OH)3]=1×10-33,Ksp[Fe(OH)3]=l×10-39, pH=7.1 时 Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4液中的Fe3+、Al3+(使其浓度小于1× l0-6mol /L),需调节溶液pH范围为_______。
(3)由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式___________。
(4)将MnO2和 Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600℃750℃,制取产品LiMn2O4。写出该反应的化学方程式 _____________ 。
(5)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixC![]() LiMn2O4+C(0<x<1)
LiMn2O4+C(0<x<1)

①充电时,电池的阳极反应式为_________,若此时转移lmole-,则石墨电极将增重______g。
②废旧锰酸锂电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com