
 ,则原混合气体中O2和NO2的体积比为
,则原混合气体中O2和NO2的体积比为 ,说明剩余气体为
,说明剩余气体为 ,可能是剩余氧气,也可以是剩余的二氧化氮气体与水反应生成的一氧化氮剩余,所以设O2体积为设混合气体总体积为5L,则如果剩余氧气时,O2和NO2按照1:4反应的混合气体为
,可能是剩余氧气,也可以是剩余的二氧化氮气体与水反应生成的一氧化氮剩余,所以设O2体积为设混合气体总体积为5L,则如果剩余氧气时,O2和NO2按照1:4反应的混合气体为 ;如果剩余一氧化氮,按照O2和NO2气体按体积比1:4混合全部溶解,实际剩余二氧化氮
;如果剩余一氧化氮,按照O2和NO2气体按体积比1:4混合全部溶解,实际剩余二氧化氮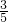 ,即可求出所有二氧化氮和氧气的体积,进而求的原混合气体中O2和NO2的体积比.
,即可求出所有二氧化氮和氧气的体积,进而求的原混合气体中O2和NO2的体积比. ,说明剩余气体为
,说明剩余气体为 .
. ,其中二氧化氮为
,其中二氧化氮为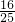 ,氧气
,氧气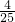 ,所以原混合气体中氧气共
,所以原混合气体中氧气共 +
+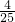 =
=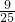 ,原混合气体中O2和NO2的体积比为
,原混合气体中O2和NO2的体积比为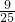 :
: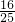 =9:16;
=9:16; 为一氧化氮,根据反应3NO2+H2O=2HNO3+NO,则相当于剩余二氧化氮
为一氧化氮,根据反应3NO2+H2O=2HNO3+NO,则相当于剩余二氧化氮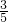 ,二氧化氮气体和氧气按4:1反应的混合气体体积为
,二氧化氮气体和氧气按4:1反应的混合气体体积为 ,其中二氧化氮体积应为
,其中二氧化氮体积应为 ×
× =
=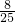 ,原混合气体中共有二氧化氮体积为
,原混合气体中共有二氧化氮体积为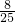 +
+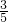 =
=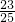 ,氧气体积为
,氧气体积为 ×
× =
=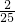 ,则原混合气体中O2和NO2的体积比为
,则原混合气体中O2和NO2的体积比为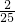 :
: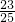 =2:23.
=2:23.

科目:高中化学 来源: 题型:解答题
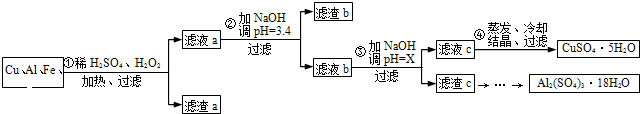
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ba2+ NH4+ Fe3+ Al3+ Fe2+ |
| 阴离子 | OH- CO32- Cl- SO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 下列关于分散系的叙述不正确的是
下列关于分散系的叙述不正确的是查看答案和解析>>
科目:高中化学 来源: 题型:多选题
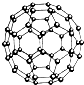 N60结构如图,28g N60单质中含有的N-N键个数为NA
N60结构如图,28g N60单质中含有的N-N键个数为NA查看答案和解析>>
科目:高中化学 来源: 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com