
【题目】已知0.1mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是()
A. 加入少量NaOH固体,钠离子和碳酸根离子浓度均增大
B. 将该溶液加水稀释,![]() 的比值保持不变
的比值保持不变
C. c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
D. c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3)
科目:高中化学 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:
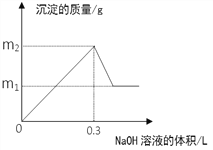
A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目:高中化学 来源: 题型:
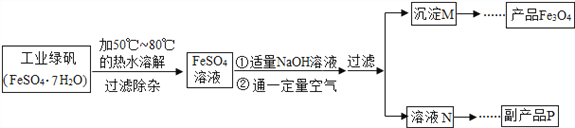
【题目】某化学兴趣小组对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图:
 【查阅资料】
【查阅资料】
资料一:硫酸亚铁在不同温度下的溶解度如表所示:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料二:Fe(OH)2受氧气氧化反应原理为:4Fe(OH)2 +2H2O+O2=4Fe(OH)3
资料三:获得Fe3O4的反应原理为:Fe(OH)2 + 2Fe(OH)3 ![]() Fe3O4+4H2O
Fe3O4+4H2O
Ⅰ【问题讨论】
(1)溶解时,用50℃至80℃的热水目的是__________________________________________。
(2)副产品P是___________________________。
(3)为了得到纯净的产品,过滤、洗涤后进行的具体操作过程为______________________________、干燥
Ⅱ【组成确定】
资料显示:①铁的氢氧化物在受热时分解生成铁的氧化物(化合物不变);
②Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe。
为确定用以上方法制得的四氧化三铁的纯度,同学们称取了23.28g该Fe3O4样品设计下列实验进行探究。
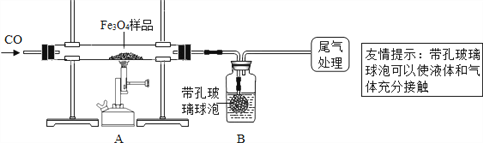
(1)该组同学欲通过称量B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质。B中的最佳试剂是_______________________(填序号)。
A.澄清石灰水 B.氢氧化钠浓溶液 C.稀盐酸 D.水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用还有:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,继续通CO气体,防止生成物被氧化,以及B中的溶液倒吸入A中;且可以_____________________________,以提高实验的精确度。
(3)利用仪器测定并绘制出反应过程中
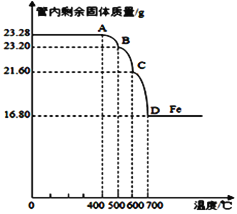
①该Fe3O4样品中含有的杂质成分______________________(填化学式)
②计算样品中Fe3O4的质量分数(写出必要的计算过程)。 _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是:
A. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C. 滴定时,左手控制滴定管活塞,右手握持锥形瓶边滴边振荡,眼睛注视滴定管中的液面
D. 称量时,称量物质放在称量纸上,置于托盘天平的左盘,砝码放出托盘天平的右盘中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
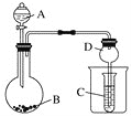
A. 若A为盐酸,B为碳酸钙,C中盛澄清石灰水,则C中先产生白色沉淀后沉淀又溶解
B. 若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
D. 实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种物质,它们之间存在如下转化关系:
![]()
(1)若X、Y、Z三种物质的焰色反应均为黄色,三个反应均为化合反应,则Y的化学式为_________,Z的电子式为_________;Y、Z两种物质相比,相同的化学键类型为__________,当由X制取Z的上述两种途径生成Z的量相等时,转移电子数目比为________。
(2)若X、Y、Z三种均为常见化合物且三种物质中均含有相同的两种短周期元素,0.1 mol/L的三种物质的溶液pH:Y>X>Z>7,则①的化学方程式为___________________,③的离子方程式为__________________。
(3)若X、Y、Z三种物质均含有同一种金属元素,X是单质,Y是日常生活中最重要的盐,②的反应条件为电解,则②的化学方程式为_________________,③的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如下图所示装置进行有关实验。

(1)此装置中,怎样检查除启普发生器之外的装置的气密性?_________________________________。
(2)请完成该实验的有关操作步骤。
①检查装置气密性;
②打开a、b产生氢气,观察试管内物质的颜色变化;
③____________________________________________________;
④加热过氧化钠,观察试管内物质的颜色变化;
⑤反应完全后,__________________________________________;
⑥拆卸装置。
(3)该装置中,碱石灰的作用是_________________________ 。
(4)实验过程中观察到(2)中步骤②无明显变化,步骤④Na2O2熔化后,黄色粉末立即变成白色,干燥管内硫酸铜未变成蓝色。则Na2O2与H2反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,11.2LCCl4含有分子数为0.5NA
B.常温常压下,17g氨气中所含原子数为NA
C.1 mol OH- 中含有电子数为10NA
D.1 mol/LBaCl2溶液中含有的氯离子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com