
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,11.2LCCl4含有分子数为0.5NA
B.常温常压下,17g氨气中所含原子数为NA
C.1 mol OH- 中含有电子数为10NA
D.1 mol/LBaCl2溶液中含有的氯离子数为2NA
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是()
A. 加入少量NaOH固体,钠离子和碳酸根离子浓度均增大
B. 将该溶液加水稀释,![]() 的比值保持不变
的比值保持不变
C. c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
D. c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验仪器,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A是制取CO2的装置,写出A中发生反应的离子方程式______________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _____________ |
C | ___________ | _______________ |
D | NaOH溶液 | _____________ |
(3)写出过氧化钠与二氧化碳反应的化学方程式______________________。
(4)用_______________检验F中收集到的气体,现象是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,NaCl溶解于水的实验数据如下表所示
实验序号 | 水的质量/g | 加入的NaCl质量/g | 未溶的NaCl质量/g |
10 | 2 | 0 | |
10 | 3 | 0 | |
10 | 4 | 0.4 |
下列叙述正确的是( )
A. 实验①所得的溶液为饱和溶液 B. 实验②所得的溶液为饱和溶液
C. 20℃时NaCl的溶解度为30g D. 实验①所得溶液的溶质质量分数为16.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )
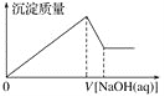
A. 有Mg2+,没有Al3+
B. 有Al3+,没有Mg2+
C. 有Mg2+和Al3+
D. 有大量的H+、Mg2+和Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O
5Cl-+ClO3-+3H2O
该兴趣小组设计了下列实验装置,进行实验。

请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是____________________。
②该兴趣小组用100mL 12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2____________g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了![]() 、
、![]() 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。

①图中曲线I表示_____________离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为______________mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中![]() 的物质的量为0.37mol,则产物中
的物质的量为0.37mol,则产物中![]() =______________。
=______________。
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 碳酸氢钠常用于治疗胃酸过多症
B. 切开的金属Na暴露在空气中,光亮表面会逐渐变暗
C. 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D. 金属钠着火时,可以使用泡沫灭火器来灭火
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com