
 H2O2
H2O2 NH4Cl
NH4Cl .
. 分析 氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
双氧水为共价化合物,其分子中存在两个氧氢键和1个氧氧键;
氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起.
解答 解:氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为: ,H2O2为共价化合物,其电子式为:
,H2O2为共价化合物,其电子式为: ;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:
;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;故答案为:
;故答案为: ;
; ;
; .
.
点评 本题考查电子式的书写,题目难度不大,注意掌握电子式的书写方法:简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青苹果只含淀粉不含糖类 | B. | 熟苹果中只含葡萄糖不含淀粉 | ||
| C. | 苹果转熟时葡萄糖合成淀粉 | D. | 苹果转熟时淀粉水解为葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA | |
| C. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
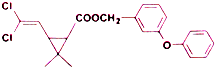
| A. | 分子式为C21H20O3Cl2 | |
| B. | 醚键上的氧原子至少与另外11个原子共面 | |
| C. | 分子中不存在手性碳原子 | |
| D. | 在一定条件下可发生加成、取代、氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | A | ||
| Y | C | B |
| A. | 元素原子半径大小顺序为:A<B<C<Y | |
| B. | 最高价含氧酸的酸性强弱顺序为:H2YO3<H2XO3 | |
| C. | A、B两种元素气态氢化物的沸点高低顺序为:HA<HB | |
| D. | B、C简单离子的还原性强弱顺序为:B-<C2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
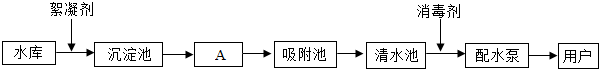
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com