
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
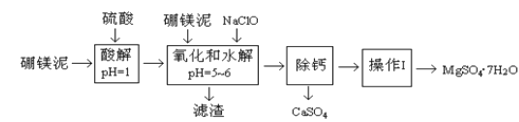
(1)实验中需要1 mol/L的硫酸980 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为____(填写选项字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有______,____。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法_____。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O。
(6)实验中提供的硼镁泥共100 g ,得到 MgSO47H2O 为196.8 g ,则MgSO47H2O 的产率为____。
【答案】D 2Fe2++ClO+2H+═2Fe3++Cl+H2O MnO2 SiO2 取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+ 蒸发浓缩(结晶)、趁热过滤 再经过过滤 80%
【解析】
硼镁泥主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体。
(1)需用1mol/L的硫酸980mL,应配制1000mL溶液,若用98%的浓硫酸(ρ=1.84g/mL)来配制,结合溶液配制前后溶质的物质的量不变可知,量取浓硫酸为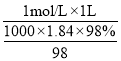 =0.054L=54mL,则选择量筒为100mL;
=0.054L=54mL,则选择量筒为100mL;
故答案为:D;
(2)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO+H2O=MnO2↓+2H++Cl,溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为2Fe2++ClO+2H+=2Fe3++Cl+H2O,
故答案为:2Fe2++ClO+2H+═2Fe3++Cl+H2O;
(3)SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液PH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤得滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,
故答案为:MnO2、SiO2;
(4)检验滤液中Fe3+是否被除尽,检验方法为取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+,
故答案为:取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+;
(5)由温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;操作I是将滤液继续蒸发浓缩,冷却结晶,再经过过滤,便得到MgSO47H2O晶体;
故答案为:蒸发浓缩(结晶)、趁热过滤;再经过过滤;
(6)硼镁泥主要成份是MgO(占40%),则100g中含Mg为100g×40%×![]() ×100%=24g,由Mg原子守恒可知得到MgSO47H2O为
×100%=24g,由Mg原子守恒可知得到MgSO47H2O为![]() ×246g/mol=246g,则MgSO47H2O的产率为
×246g/mol=246g,则MgSO47H2O的产率为![]() ×100%=80%,
×100%=80%,
故答案为:80%。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】图甲表示叶绿体的结构,图乙表示暗反应过程。请据图回答下列问题:

(l)叶绿体中的色素分布于图甲中的____ (填序号);四种色素能在滤纸条上分离,是因为____。
(2)叶绿体进行光合作用时,ATP的移动方向是从____到____(填序号),合成ATP所需的能量来自____。
(3)在光照强度、温度和CO2浓度三种环境因素中,能直接影响图乙所示过程的是 _________。若突然降低光照强度,则在短时间内叶绿体中C3和C5的含量变化分别是 _________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. 向FeCl3溶液中加KSCN,有![]() Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
C. 装有![]() 的烧瓶置于热水中颜色加深
的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为常温下向10mL0.1 mol·L-1 NH3·H2O中加入等浓度的盐酸时,NH3·H2O的物质的量随V(盐酸)的变化曲线。(电离度为已电离的NH3H2O占初始时NH3H2O的百分比),下列说法正确的是( )

A. 测得a点时溶液的pH=11,则NH3·H2O的电离度为1%
B. b点时溶液的pH=7
C. 水的电离程度:b<c
D. c点时溶液中存在关系式:2c(Cl-)=c(NH4+) +c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的数值为NA,则下列说法正确的是( )
A. 常温常压下,11.2 L甲烷中含有的氢原子数为2NA
B. 标准状况下,0.3 mol二氧化硫中含有的氧原子数为0.3×6.02×1023
C. 标准状况下,2.7 g Al与足量的盐酸反应,生成H2的体积是22.4L
D. 常温下,1 L 0.1 mol·L-1MgCl2溶液中含Cl-数为0.2moL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
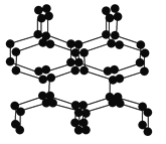
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,从A处通入新制备的Cl2,关闭B阀时,C处的红色布条看不到明显现象;当打开B阀后,C处红色布条逐渐褪色。D瓶中装的是( )

①浓硫酸 ②NaOH溶液 ③H2O ④饱和NaCl溶液
A. ①③ B. ②④ C. ①② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D, E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第_______周期_______族;B元素和C元素的第一电离能比较,较大的是________,C元素和F元素的电负性比较,较小的是________。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子模型为________,B元素所形成的单质分子![]() 键与π键数目之比为________。
键与π键数目之比为________。
(3)G元素的低价阳离子的离子结构示意图是________,F元素原子的价电子的轨道表示式是________,H元素的基态原子核外电子排布式的________。
(4)G的高价阳离子的溶液与H单质反应的离子方程式为_________________;与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础。
(1)其中标示出使用温度的仪器是________________。
(2)下列操作中,容量瓶所不具备的功能有________________ (填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的溶液 D.准确稀释某一浓度的溶液
E.量取一定体积的液体 F.用来加热溶解固体溶质
(3)如图是某些仪器的刻度部分示意图,图中各仪器虚线为所示读数。其中为量筒的是________________ (填编号,),读数为_____mL。

(4)实验室用98%的浓硫酸配制(浓硫酸的密1.84g/mL)450mL 0.1 mol·L-1的硫酸。回答下列问题
① 配制中应选用的玻璃仪器有_________________,应量取________mL 98%的浓硫酸。
② 量筒在使用前已洗干净但不干燥,对结果是否造成影响________(填“是”或“否”),某同学认为将量筒内的浓硫酸倒出之后,应将量筒洗涤—下并将洗涤液倒入烧杯中,最后转移到容量瓶中,你认为他的做法______(填“对”或“错”)。
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于 0.1mol/L有 ______(填序号)
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com