
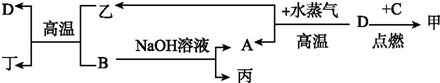
分析 A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,甲、乙、丙为常见化合物,B能与NaOH溶液反应,则B应为Al,A为H2,丙为NaAlO2,而D在高温下与H2O(g)反应得到H2,可得D为Fe,所以得乙为Fe3O4,Fe3O4和Al发生铝热反应生成Fe和Al2O3,所以丁为Al2O3.又单质C与Fe反应,所以C应为一种非金属单质,且由A、B、C、D原子序数依次增大,所以C是硫或氯气,结合点燃条件知C为Cl2,甲为FeCl3.
解答 解:A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,甲、乙、丙为常见化合物,B能与NaOH溶液反应,则B应为Al,A为H2,丙为NaAlO2,而D在高温下与H2O(g)反应得到H2,可得D为Fe,所以得乙为Fe3O4,Fe3O4和Al发生铝热反应生成Fe和Al2O3,所以丁为Al2O3.又单质C与Fe反应,所以C应为一种非金属单质,且由A、B、C、D原子序数依次增大,所以C是硫或氯气,结合点燃条件知C为Cl2,甲为FeCl3.
(1)A的化学式为H2,乙的化学式为Fe3O4,故答案为:H2;Fe3O4;
(2)D与甲反应的化学方程式为:Fe+2FeCl3=3FeCl2 ,故答案为:Fe+2FeCl3=3FeCl2 ;
(3)B与NaOH 溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应的氧化剂为H2O,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;H2O;
(4)B生成D 的反应称为铝热反应,实验室中,进行这个反应的操作为:一定量的铝热剂,一层氯酸钾,插上燃烧的镁条,
故答案为:铝热;一定量的铝热剂,一层氯酸钾,插上燃烧的镁条.
点评 本题考查无机物的推断,涉及Fe、Al等元素化合物性质与转化,B与氢氧化钠溶液为推断突破口,学习中注意基础知识的积累.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 向含少量苯酚的苯中加入适量溴水后过滤,可除去苯酚 | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN溶液,溶液变成血红色,说明该溶液中一定含有Fe3+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明Fe2+是被HClO所氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
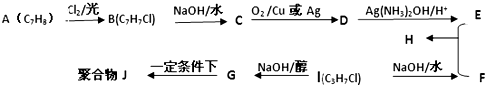
 ,C的官能团名称醇羟基.
,C的官能团名称醇羟基. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═H22++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaOH═Na++O2-+H+ | D. | Na2SO4═2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲装置为铁的析氢腐蚀,若将铁换成铜,则甲装置就是铜的吸氧腐蚀 | |
| B. | 若将甲装置中的电流表改为电源,无论电源怎么连接,C电极上都会有气体放出 | |
| C. | 乙装置中K关闭后,a极附近颜色逐渐加深变黑 | |
| D. | 若将乙装置中的NaOH溶液换为HCl溶液,则K关闭后b极颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
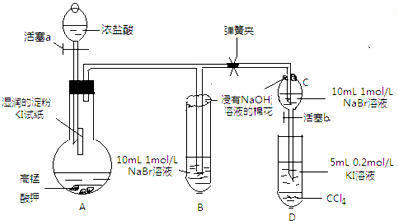 某研究性学习小组进行如下探究活动:
某研究性学习小组进行如下探究活动:| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与HCl反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Cu与AgNO3反应:2Ag++Cu═Cu2++2Ag | |
| C. | 醋酸与NaOH反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | CuSO4与Ba(OH)2反应:Cu2++2OH-+SO42-+Ba2+═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com