
| 元素 | 相关信息 |
| W | W的基态原子L层电子数是K层电子数的3倍 |
| X | X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝 |
| Y | 单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4 |
| Z | Z的基态原子外围电子排布式为(n-1)d10ns1 |
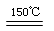 Cu2O + H2O (2分)
Cu2O + H2O (2分)  Cu2O + H2O
Cu2O + H2O

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子核外电子层数越多,原子半径越大 |
| B.每一主族所含非金属元素的种类可表示为︳族序数-2? |
C.根据泡利原理将氧元素基态原子的电子排布图书写为 |
| D.C2H2分子中的碳采取sp2杂化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | Y | V | | |
| X | | | | W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径A>B>C>D |
| B.原子序数a>b>c>d |
| C.离子半径C3->D->B+>A2+ |
| D.单质的还原性A>B>D>C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热稳定性:SiH4>PH3>H2 S |
| B.酸性:HClO4>H2SO4>H3 PO4 |
| C.碱性:NaOH>Mg(OH)2>AI(OH)3 |
| D.氧化性:F2>C12>Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com